रासायनिक बदल व रासायनिक बंध
इयत्ता-आठवी – सामान्य विज्ञान-पाठ -13- Maharashtra Board
नोट्स
अभ्यासघटक :
|
बदलांच्या विविध पद्धती : भौतिक बदल आणि रासायनिक बदल.
- भौतिक बदलात मूळ पदार्थाचे संघटन बदलत नाही व नवीन पदार्थ तयार होत नाही.
- रासायनिक बदलात मूळ पदार्थाचे संघटन बदलते व वेगळ्या गुणधर्मांचा नवीन पदार्थ तयार होतो.
उदाहरण :
- भौतिक बदल : बर्फ वितळणे, पाणी उकळणे, पाण्यात मीठ विरघळणे.
- रासायनिक बदल : कैरीचा आंबा होणे, हिरवे केळे पिवळे होणे, फळ पिकल्यावर सुगंध येणे, बटाटा चिरून ठेवल्यावर काळा पडणे, फुगवलेला फुगा फट्दिशी फुटणे, फटाका पेटवल्यावर आवाज होणे, खाद्यपदार्थ खराब झाल्यावर आंबूस वास येणे.
रासायनिक बदल व शाब्दिक समीकरण :
- रासायनिक बदल घडताना मूळच्या द्रव्याचे रासायनिक संघटन बदलून, वेगळे रासायनिक संघटन असलेले वेगळ्या गुणधर्मांचे नवीन पदार्थ तयार होतात.
- रासायनिक संघटनातील बदल नेमकेपणाने माहीत असल्यास रासायनिक बदलासाठी रासायनिक अभिक्रिया लिहिता येते.
- रासायनिक अभिक्रिया लिहिताना मूळच्या द्रव्यातील रासायनिक पदार्थाचे नाव व रासायनिक सूत्र, तसेच तयार झालेल्या नवीन पदार्थाचे नाव व रासायनिक सूत्र यांचा उपयोग करतात.
उदाहरणार्थ, लिंबू रसात खाण्याचा सोडा मिसळला. या रासायनिक अभिक्रियेसाठी पुढीलप्रमाणे शाब्दिक समीकरण लिहिता येते.
सायट्रिक आम्ल + सोडिअम बायकार्बोनेट → कार्बन डायऑक्साइड + सोडिअम सायट्रेट
आम्ल + आम्लारी → CO2 + क्षार
ही उदासिनीकरण अभिक्रिया आहे.
लक्षात ठेवा :
- एखादी रासायनिक अभिक्रिया लिहिण्याची पहिली पायरी म्हणजे संबंधित पदार्थांची नावे वापरून शाब्दिक समीकरण लिहिणे ही होय.
- यात प्रत्येक नावाऐवजी त्या पदार्थाचे रासायनिक सूत्र लिहिले की ते रासायनिक समीकरण होते.
- रासायनिक अभिक्रिया लिहिताना मूळचे पदार्थ डाव्या बाजूला, तर तयार झालेले नवीन पदार्थ उजव्या बाजूला लिहितात व मध्ये बाण काढतात. या बाणाचे टोक तयार झालेल्या पदार्थांच्या दिशेला असते.
- हा अभिक्रियेची दिशा दर्शवणारा बाण आहे. बाणाच्या डाव्या बाजूला.लिहिलेले मूळचे पदार्थ म्हणजेच अभिक्रियेत भाग घेणारे पदार्थ होत. त्यांना अभिक्रियाकारक किंवा अभिकारक म्हणतात.
- अभिक्रियेमुळे तयार होणाऱ्या नवीन पदार्थांना उत्पादित म्हणतात. अभिक्रियेतील उत्पादितांची जागा बाणाच्या उजव्या बाजूला असते.
दैनंदिन जीवनातील रासायनिक बदल :
नैसर्गिक रासायनिक बदल :
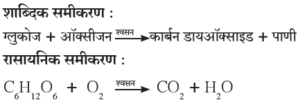
(a) श्वसन : श्वसन ही सतत चालू असणारी जैविक प्रक्रिया आहे.
- या क्रियेमध्ये आपण श्वासावाटे हवा आत घेतो व उच्छ्वासावाटे कार्बन डायऑक्साइड वायू व पाण्याची वाफ बाहेर पडतात.
- श्वासावाटे घेतलेल्या हवेतील ऑक्सिजनची पेशींमधील ग्लुकोजबरोबर अभिक्रिया होऊन कार्बन डायऑक्साइड व पाणी हे तयार होतात.
या रासायनिक अभिक्रियेचे शाब्दिक व रासायनिक समीकरण पुढीलप्रमाणे आहे.
(b) प्रकाश-संश्लेषण : सूर्यप्रकाशात हिरव्या वनस्पती प्रकाश-संश्लेषण करतात. या नैसर्गिक रासायनिक बदलासाठी शाब्दिक समीकरण व रासायनिक समीकरण (असंतुलित) पुढीलप्रमाणे लिहिता येते :

मानवनिर्मित रासायनिक बदल :
(a) इंधनाचे ज्वलन : ऊर्जा मिळवण्यासाठी लाकूड, कोळसा, पेट्रोल किंवा स्वयंपाकाचा गॅस जाळतात.
कार्बन हा सर्व इंधनांमध्ये ज्वलन होणारा एक सामाईक पदार्थ आहे. ज्वलन प्रक्रियेमध्ये कार्बनचा संयोग हवेतील ऑक्सिजनबरोबर होतो व कार्बन डायऑक्साइड हे उत्पादित तयार होते. या सर्व ज्वलनांच्या क्रियांसाठी सामाईक असे पुढील समीकरण लिहिता येते :
शाब्दिक समीकरण :
कार्बन + ऑक्सिजन → कार्बन डायऑक्साइड
रासायनिक समीकरण :
C + O2 → CO2
इंधनाचे ज्वलन हा जलद व अपरिवर्तनीय असा रासायनिक बदल आहे.
(b) विरल हायड्रोक्लोरिक आम्लाने शहाबादी फरशी स्वच्छ करणे : शहाबादी फरशीचा मुख्य रासायनिक घटक कॅल्शिअम कार्बोनेट हा आहे.
- फरशी हायड्रोक्लोरिक आम्लाने स्वच्छ करताना फरशीच्या वरच्या थराची हायड्रोक्लोरिक आम्लाबरोबर रासायनिक अभिक्रिया होते व तीन उत्पादिते तयार होतात.
- त्यांपैकी एक कॅल्शिअम क्लोराइड; हे पाण्यात द्रावणीय असल्याने पाण्याने धुतल्यावर निघून जाते. दुसरे उत्पादित म्हणजे कार्बन डायऑक्साइड, याचे बुडबुडे हवेत मिसळून जातात. तिसरे उत्पादित पाणी, जे पाण्यात मिसळून जाते.
या रासायनिक बदलासाठी पुढील समीकरण लिहिता येते :
शाब्दिक समीकरण :
कॅल्शिअम कार्बोनेट + हायड्रोक्लोरिक आम्ल → कॅल्शिअम क्लोराइड + कार्बन डायऑक्साइड + पाणी
(c) दुष्फेन पाणी सुफेन बनवणे : काही विहिरींचे किंवा कूपनलिकांचे पाणी दुष्फेन असते. ते चवीला मचूळ लागते व त्यात साबणाचा फेस होत नाही. याचे कारण दुष्फेन पाण्यात कॅल्शिअम व मॅग्नेशिअमचे क्लोराइड व सल्फेट हे क्षार विरघळलेले असतात.
हे दुष्फेन पाणी सुफेन करण्यासाठी त्यात धुण्याच्या सोड्याचे द्रावण घालतात. त्यामुळे रासयनिक अभिक्रिया होऊन कॅल्शिअम व मॅग्नेशिअमच्या अद्रावणीय कार्बोनेट क्षारांचा अवक्षेप तयार होऊन तो बाहेर पडतो.
पाण्यातील विरघळलेले कॅल्शिअम व मॅग्नेशिअमचे क्षार कार्बोनेट क्षारांच्या अवक्षेपाच्या रूपात बाहेर पडल्याने पाणी सुफेन होते. या रासायनिक बदलासाठी पुढील समीकरण लिहिता येते :
शाब्दिक समीकरण :
कॅल्शिअम क्लोराइड + सोडिअम कार्बोनेट → कॅल्शिअम कार्बोनेट + सोडिअम क्लोराइड
रासायनिक समीकरण (असंतुलित) :
CaCl2 + Na2CO3 → CaCO3 + NaCl
रासायनिक बंध (Chemical Bond) :
- राजवायू रासायनिक बंध तयार करीत नाहीत व त्यांचे इलेक्ट्रॉन अष्टक/द्विक पूर्ण असते. याउलट इलेक्ट्रॉन अष्टक/द्विक पूर्ण नसलेले अणू रासायनिक बंध तयार करतात.
- रासायनिक बंध तयार करताना अणू त्यांच्या संयुजा इलेक्ट्रॉनांचा उपयोग करतात.
- संयुजेच्या संख्येइतके रासायनिक बंध तयार केल्यावर अणूला इलेक्ट्रॉन अष्टकाचे/द्विकांचे संरूपण प्राप्त होते.
इलेक्ट्रॉन अष्टक / द्विक पूर्ण करण्याच्या दोन प्रमुख पद्धती :
(i) आयनिक बंध (Ionic Bond) : परस्परविरुद्ध प्रभार असलेल्या धन आयन व ऋण आयन यांच्यामधील स्थितिक विद्युत आकर्षण बलामुळे तयार होणाऱ्या रासायनिक बंधाला आयनिक बंध किंवा विद्युत संयुजा बंध म्हणतात.
- एक किंवा अधिक आयनिक बंधांमुळे तयार होणाऱ्या संयुगाला आयनिक संयुग म्हणतात. उदा सोडिअम क्लोराइड (NaCI) , मॅग्नेशिअम क्लोराइड (MgCl2) ही आयनिक संयुगे आहेत.
- आयनावर असलेल्या +1 किंवा -1 विद्युतप्रभारामुळे एक आयनिक बंध तयार होतो.
- आयनावर जितका धनप्रभार किंवा ॠणप्रभार असतो ती त्या आयनाची संयुजा असते व संयुजेइतके आयनिक बंध तो आयन तयार करतो.
उदा.,
(a) सोडिअम क्लोराइड (NaCI) :
सोडिअम व क्लोरिनचे इलेक्ट्रॉन संरूपण : 11Na - 2,8,1; 17Cl - 2,8,7
- सोडिअमचा अणुअंक 11 आहे व सोडिअमचे इलेक्ट्रॉन संरूपण 2, 8, 1 आहे.
- सोडिअमच्या (Na) अणूमध्ये बाहयतम कवचात एक इलेक्ट्रॉन असतो.
- सोडिअम अणू M कवचात एक इलेक्ट्रॉन गमावतो व L कवच हे बाह्यतम कवच होते व या कवचाचे स्थिर अष्टक असते. सोडिअमच्या केंद्रकात प्रोटॉन्सची संख्या 11 असते; मात्र 1 इलेक्ट्रॉन गमावल्यामुळे इलेक्ट्रॉनची संख्या 10 होते. परिणामी एक धनप्रभार अधिक होऊन सोडिअमचा धनप्रभारित आयन (Na+ कॅटायन) तयार होतो.
- क्लोरीनच्या अणूत बाह्यतम कवचात सात इलेक्ट्रॉन असतात व अष्टक स्थिती प्राप्त करण्याकरिता एक इलेक्ट्रॉनची गरज असते.
- अशा रितीने सोडिअम अणू एक इलेक्ट्रॉन क्लोरीनच्या अणूला देतो.
- जेव्हा क्लोरीनचा अणू एक इलेक्ट्रॉन स्वीकारतो तेव्हा क्लोरीनचे अष्टक पूर्ण होते व क्लोरीनच्या K, L आणि M या कवचांमध्ये मिळून इलेक्ट्रॉनची संख्या एकूण 18 होते. परंतु केंद्रकामधील प्रोटॉन्सची संख्या मात्र 17 एवढीच राहते. यामुळे क्लोरीन अणूचे क्लोराइड ऋणप्रभारित आयनाची (Cl-) निर्मिती होते.
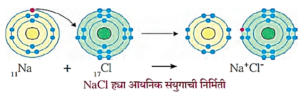
- अशा रितीने, क्लोरीनचा अणू एक इलेक्ट्रॉन सोडिअमकडून स्वीकारून क्लोराइड ऋणप्रभारित आयन व सोडिअम अणू एक इलेक्ट्रॉन देऊन सोडिअमचा धनप्रभारित आयन तयार होतात.
- सोडिअम आयन आणि क्लोराइड आयनांवर विरुद्ध प्रभार असल्याकारणाने परस्परांमध्ये तीव्र आकर्षणाचे बल तयार होते. परिणामी त्यांच्यामध्ये इलेक्ट्रोव्हॅलंट किंवा आयनिक बंध तयार होतो व सोडिअम क्लोराइड रेणू (संयुग) तयार होते.
(b) मॅग्नेशिअम क्लोराइड (MgCl2) : मॅग्नेशिअम क्लोराईड ह्या आयनिक संयुगाची निर्मिती मॅग्नेशिअम व क्लोरीन या मूलद्रव्यांपासून कशी होते ते खालील आकृती मध्ये दाखविले आहे.

धातू व अधातू यांच्या संयोगाने आयनिक संयुगे तयार होण्याचे कारण :
|
(ii) सहसंयुज बंध : दोन अणूंनी एकमेकांबरोवर आपापले संयुजा इलेक्ट्रॉन संदान केल्यावर जो रासायनिक बंध तयार होतो, त्याला सहसंयुज बंध म्हणतात.
- दोन संयुजा इलेक्ट्रॉनांच्या संदानाने एक सहसंयुज बंध तयार होतो.
- उदा., हायड्रोजन, ऑक्सिजन, पाणी ही सहसंयुज संयुगे आहेत.
पाणी या सहसंयुज रेणूची निर्मिती :
- हायड्रोजनचा अणुअंक 1 आहे आणि इलेक्ट्रॉन संरूपण 1 आहे.
- हायड्रोजनच्या (H) अणूमध्ये K या बाह्यतम कवचात 1 इलेक्ट्रॉन आहे.
- ऑक्सिजनचा अणुअंक 8 आहे. इलेक्ट्रॉन संरूपण 2, 6 आहे. ऑक्सिजन अणूच्या बाह्यतम कवचात सहा इलेक्ट्रॉन असतात व अष्टक स्थिती प्राप्त करण्याकरिता दोन इलेक्ट्रॉनची गरज असते. म्हणजेच ऑक्सिजनची संयुजा 2 आहे.
- H2O रेणूमध्ये ऑक्सिजन अणू दोन सहसंयुज बंध करून आपले इलेक्ट्रॉन अष्टक पूर्ण करतो. ऑक्सिजनचा एक अणू हे दोन सहसंयुज बंध दोन हायड्रोजन अणूंबरोबर प्रत्येकी एक याप्रमाणे करतो. यामुळे दोन्ही हायड्रोजन अणूंचे इलेक्ट्रॉन द्विक स्वतंत्रपणे पूर्ण होते.

Click on link to get PDF from store
PDF : MSBSHSE-इयत्ता-आठवी – सामान्य विज्ञान-पाठ-13-रासायनिक बदल व रासायनिक बंध - नोट्स
PDF : MSBSHSE-इयत्ता-आठवी – सामान्य विज्ञान-पाठ-13-रासायनिक बदल व रासायनिक बंध - स्वाध्याय प्रश्नोत्तरे
Useful links :
| Main Page : - Maharashtra Board इयत्ता-आठवी – सामान्य विज्ञान - All chapters notes, solutions, videos, test, pdf.
Previous Chapter : पाठ - 12 : आम्ल, आम्लारी ओळख - Online Notes Next Chapter : पाठ - 14 : उष्णतेचे मापन व परिणाम - Online Notes |
