अणूचे अंतरंग
इयत्ता-आठवी – सामान्य विज्ञान-पाठ -5- Maharashtra Board
नोट्स
अभ्यासघटक :
|
द्रव्य : द्रव्य हे लहान कणांचे बनलेले असते.
अणू : सर्व भौतिक व रासायनिक बदलांमध्ये आपली रासायनिक ओळख कायम राखणारा मूलद्रव्याचा लहानात लहान कण म्हणजे अणू होय. अणू हे द्रव्याचे सर्वांत लहान एकक आहे.
डाल्टनचा अणुसिद्धांत :
- डाल्टनच्या अणुसिद्धांतानुसार द्रव्य हे अणूंचे बनलेले असते व अणू हे अविभाजनीय व अनाशवंत असतात.
- एका मूलद्रव्याचे सर्व अणू एकसमान असतात, तर भिन्न मूलद्रव्यांचे अणू भिन्न असतात व त्यांचे वस्तुमान भिन्न असते.

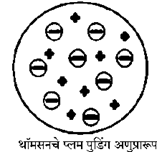
थॉमसनचे प्लम पुडिंग अणुप्रारूप :
- थॉमसनच्या अणुप्रारूपानुसार अणूमध्ये सर्वत्र धनप्रभारयुक्त जेल पसरलेला असतो व त्यामध्ये ऋणप्रभारित इलेक्ट्रॉन्स जडवलेले असतात. (प्लम पुडिंग प्रतिकृती)
- पसरलेल्या धनप्रभाराचे संतुलन इलेक्ट्रॉनांवरील ऋणप्रभारामुळे होते. त्यामुळे अणू विद्युतप्रभारदृष्ट्या उदासीन होतो.
- थॉमसनच्या प्रारूपानुसार अणूमध्ये वस्तुमानाचे वितरण सर्वत्र एकसमान असते. डाल्टनच्या अणुसिद्धांतामध्ये वस्तुमानाच्या वितरणासंबंधी काहीही उल्लेख नाही.
रूदरफोर्डचे केंद्रकीय अणूप्रारूप (1911) :
- रूदरफोर्डचे अणुप्रारूपानुसार अणूच्या केंद्रभागी अतिशय लहान, भरीव धनप्रभारित केंद्रक असते.
- अणूचे जवळजवळ सर्व वस्तुमान केंद्रकात एकवटलेले असते.
- केंद्रकाभोवती इलेक्ट्रॉन नावाचे ऋणप्रभारित कण परिभ्रमण करीत असतात.
- सर्व इलेक्ट्रॉनांवरील एकत्रित ऋणप्रभार हा केंद्रकावरील धनप्रभाराएवढा असल्याने विजातीय प्रभारांचे संतुलन होऊन अणू हा विद्युतदृष्ट्या उदासीन असतो.
- परिभ्रमण करणारे इलेक्ट्रॉन व अणुकेंद्रक यांच्या दरम्यान पोकळी असते.
रुदरफोर्डचा विकिरण प्रयोग :
किरणोत्सारी मूलद्रव्यातून उत्सर्जित होणारे α-कण हे धनप्रभारित आहेत. रुदरफोर्डने अल्फा (α-) कणांचा सोन्याच्या अतिशय पातळ पत्र्यावर मारा केला व कणांच्या मार्गांचा वेध घेतला.
सोन्याच्या पत्र्याभोवती प्रतिदीप्तिमान पडदा लावून, त्यांना जर अणूंमध्ये धनप्रभारित वस्तुमानाचे वितरण सर्वत्र एकसमान असेल, तर धनप्रभारित a-कणांचे पत्र्यावरून परावर्तन होईल अशी अपेक्षा होती.
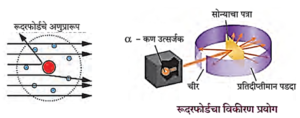
- बहुसंख्य α-कण पत्र्यातून आरपार सरळ गेले.
- काही थोड्या α-कणांचे मूळ मार्गापासून लहान कोनातून विचलन झाले.
- आणखी थोड्या α-कणांचे मोठ्या कोनातून विचलन झाले आणि
- आश्चर्य म्हणजे 20000 पैकी एक α-कण मूळ मार्गाच्या उलट दिशेने उसळला.
मोठ्या संख्येने आरपार गेलेले α-कण असे दर्शवतात की त्यांच्या वाटेत कोणताच अडथळा नव्हता. याचा अर्थ सोन्याच्या स्थायुरूप पत्र्यामधील अणूंच्या आत बरीचशी जागा मोकळीच असली पाहिजे. ज्या थोड्या α-कणांचे लहान किंवा मोठ्या कोनातून विचलन झाले त्यांच्या वाटेत अडथळा आला. याचा अर्थ अडथळ्यास कारण असलेला अणूचा धनप्रभारित व जड भाग अणूच्या मध्यभागी होता. यावरून रुदरफोर्डने अणूचे केंद्रकीय प्रारूप मांडले.
α-कणांच्या विकिरणाच्या प्रयोगाचे निष्कर्ष :
रुदरफोर्डने केलेल्या अल्फा कणांच्या विकिरणासंबंधी प्रयोगाचे निष्कर्ष असे :
- अणूच्या केंद्रभागी धनप्रभारित केंद्रक असते.
- केंद्रकात अणूचे जवळजवळ सर्व वस्तुमान एकवटलेले असते.
- केंद्रकाभोवती इलेक्ट्रॉन नावाचे ऋणप्रभारित कण परिभ्रमण करीत असतात.
- सर्व इलेक्ट्रॉनांवरील एकत्रित ऋणप्रभार हा केंद्रकावरील धनप्रभाराएवढा असल्याने विजातीय प्रभारांचे संतुलन होऊन अणू हा विद्युतदृष्ट्या उदासीन असतो.
- परिभ्रमण करणारे इलेक्ट्रॉन व अणुकेंद्रक यांच्या दरम्यान पोकळी असते.
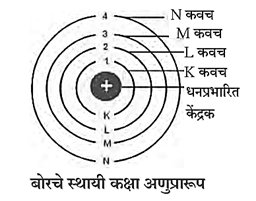
बोरचे स्थायी कक्षा अणुप्रारूप (1913) :
सन 1913 मध्ये डॅनिश वैज्ञानिक नील्स बोर यांनी स्थायी कक्षा अणुप्रारूप मांडून अणूचा स्थायीभाव स्पष्ट केला.
- अणूच्या केंद्रकाभोवती परिभ्रमण करणारे इलेक्ट्रॉन केंद्रकापासून विशिष्ट अंतरावर असणाऱ्या समकेंद्री वर्तुळाकार कक्षांमध्ये असतात.
- विशिष्ट कक्षेत असताना इलेक्ट्रॉनची ऊर्जा स्थिर असते.
- इलेक्ट्रॉन आतील कक्षेतून बाहेरील कक्षेत उडी मारताना विशिष्ट परिमाणाच्या ऊर्जेचे शोषण करतो, तर बाहेरील कक्षेतून आतील कक्षेत उडी मारताना विशिष्ट परिमाणाची ऊर्जा उत्सर्जित करतो.
- ही विशिष्ट ऊर्जा म्हणजे इलेक्ट्रॉन बाहयकक्षेत असताना त्याची असलेली ऊर्जा व इलेक्ट्रॉन आतल्या कक्षेत असताना त्याची असलेली ऊर्जा यांमधील फरक होय.
उदाहरणे :
- घरातील गॅसच्या शेगडीच्या निळ्या ज्योतीमध्ये मिठाचे (सोडिअम क्लोराइडचे) कण टाकल्यावर त्या क्षणी त्या जागी पिवळी ठिणगी दिसते.
- पाण्यात सोडिअम धातूचा तुकडा टाकला असता तो पेटून पिवळी ज्योत दिसते.
- रस्त्यावरील सोडिअम व्हेपर दिव्यांमधूनही त्याच पिवळ्या रंगाचा प्रकाश येतो.
- ह्या सर्व उदाहरणांमध्ये सोडिअम अणूमधील इलेक्ट्रॉन ऊर्जा शोषून बाहेरील कक्षेमध्ये जातो व पुन्हा आतील कक्षेमध्ये उडी मारून परत येताना ती ऊर्जा उत्सर्जित करतो.
- सोडिअम अणूच्या या दोन कक्षांच्या ऊर्जा पातळीतील फरक ठराविक असतात.
- हा फरक पिवळ्या प्रकाशाच्या ऊर्जेइतका असतो.
म्हणून वरील तिन्ही उदाहरणांमध्ये तोच विशिष्ट पिवळा प्रकाश बाहेर पडल्याचे दिसते.
अणूची संरचना :
केंद्रक व केंद्रकाबाहेरील भाग यांचा मिळून अणू बनतो. यांच्यामध्ये तीन प्रकारच्या
अवअणुकणांचा समावेश असतो.
केंद्रक : अणूचे केंद्रक धनप्रभारित असते. अणूचे जवळजवळ सर्व वस्तुमान केंद्रकात एकवटलेले असते. केंद्रकामध्ये दोन प्रकारचे अवअणुकण असतात.
एकत्रितपणे त्यांना न्युक्लिऑन म्हणतात. प्रोटॉन व न्यूट्रॉन हे न्युक्लिऑनचे दोन प्रकार आहेत.
- प्रोटॉन (p) : प्रोटॉन हा धन प्रभारयुक्त मूलकण आहे. हे मूलकण अणुकेंद्रकात असतात.
- न्यूट्रॉन (n) : न्यूट्रॉनवर कोणताच प्रभार नसतो. न्यूट्रॉन (n) हे मूलकण केंद्रकात असतात.
- इलेक्ट्रॉन (e) : इलेक्ट्रॉन हा ऋणप्रभारित मूलकण आहे. e- हे ऋणप्रभाराचे मूलभूत एकक मानण्यात येते. इलेक्ट्रॉन हे अणुकेंद्रकाभोवती विशिष्ट कक्षांमध्ये परिभ्रमण करतात.
अणुक्रमांक (Z) : अणूमधील इलेक्ट्रॉन किंवा प्रोटॉनच्या संख्येला त्या अणूचा अणुक्रमांक म्हणतात. त्याचा Z या अक्षराने निर्देश करतात.
अणुवस्तुमानांक (A) : मूलद्रव्याच्या अणूतील केंद्रकात असणाऱ्या प्रोटॉन (p) आणि न्यूट्रॉन (n)
यांच्या एकत्रित संख्येला त्या मूलद्रव्याचा अणुवस्तुमानांक म्हणतात. त्याचा A या अक्षराने निर्देश करतात.
- प्रोटॉन व न्यूट्रॉन हे दोन्हीही पूर्णांकात असल्याने अणुअंक (Z) व अणवस्तुमानांक (A) नेहमी पूर्णांकातच असतात.
इलेक्ट्रॉन वितरण : बोरच्या अणुप्रारूपानुसार इलेक्ट्रॉन स्थायी कवचांमध्ये परिभ्रमण करतात. या कवचांना विशिष्ट ऊर्जा असते. अणुकेंद्रकाच्या सर्वांत जवळ असलेल्या कवचाला पहिले कवच, त्यानंतरच्या कवचाला दुसरे कवच म्हणतात. कवचांच्या क्रमांकांसाठी 'n' ही संज्ञा वापरतात. n = 1, 2, 3, 4 ... या क्रमांकांनुसार कवचांना K, L, M, N ... या संज्ञांनी संबोधण्यात येते. प्रत्येक कवचात जास्तीत जास्त '2n2. या सूत्राने मिळालेल्या संख्येइतके इलेक्ट्रॉन असू शकतात. 'n' चे मूल्य वाढते तशी त्या कवचातील इलेक्ट्रॉनची ऊर्जा वाढते.
मूलद्रव्यांचे इलेक्ट्रॉन संरूपण : आपण पाहिले की K, L, M, N, ... या कवचांमध्ये अनुक्रमे जास्तीत जास्त, 2, 8, 18, 32, ... इलेक्ट्रॉन सामावू शकतात. हीच कवचांची कमालधारकता होय.
- कवचांच्या कमालधारकतेनुसार अणूमधील इलेक्ट्रॉनांचे कवचांमध्ये वितरण होते.
- एखाद्या मूलद्रव्याच्या अणूमधील इलेक्ट्रॉनांची कवचनिहाय मांडणी म्हणजे त्या मूलद्रव्याचे इलेक्ट्रॉन संरूपण होय.
- प्रत्येक इलेक्ट्रॉनकडे तो ज्या कवचात असतो त्यानुसार निश्चित अशी ऊर्जा असते.
- पहिल्या कवचातील (K कवच) इलेक्ट्रॉनांची ऊर्जा सर्वांत कमी असते. त्यापुढील कवचामधील इलेक्ट्रॉनची ऊर्जा कवचक्रमांकाप्रमाणे वाढत जाते.
- मूलद्रव्याच्या अणूचे इलेक्ट्रॉन संरूपण असे असते की त्यायोगे सर्व इलेक्ट्रॉनांची एकत्रित ऊर्जा कमीत कमी असते.
- अणूतील इलेक्ट्रॉन कवचांच्या कमाल धारकतेप्रमाणे तसेच ऊर्जेच्या चढत्या क्रमानुसार असलेल्या कवचांमध्ये स्थान मिळवतात.
काही मूलद्रव्यांचे संरूपण :
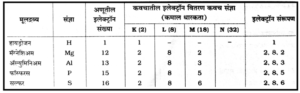
संयुजा (Valency) व इलेक्ट्रॉन संरूपण (Electronic configuration) :
संयुजा : मूलद्रव्याच्या इतर मूलद्रव्यांशी संयोग पावण्याच्या क्षमतेला संयुजा म्हणतात.
संयुजा कवच : अणूची संयुजा बाह्यतम कवचातील इलेक्ट्रॉन संरूपणावरून ठरवता येते. म्हणून बाह्यतम कवचाला संयुजा कवच म्हणतात. बाह्यतम कवचातील इलेक्ट्रॉन म्हणजे संयुजा इलेक्ट्रॉन होत.
- "ज्या मूलद्रव्यात संयुजा इलेक्ट्रॉन संख्या चार किंवा त्यापेक्षा कमी असते त्या मूलद्रव्याची संयुजा त्यातील संयुजा इलेक्ट्रॉन संख्येएवढी असते,
- याउलट ज्या मूलद्रव्यात चार किंवा त्याहून अधिक इलेक्ट्रॉन असतात तेव्हा अष्टक पूर्ण होण्यासाठी जितके इलेक्ट्रॉन कमी असतात. ती उणिवेची संख्या म्हणजे त्या मूलद्रव्याची संयुजा असते."
| मूलद्रव्य | Na | C | Mg | Cl |
| इलेक्ट्रॉन संख्या | 11 | 6 | 12 | 17 |
| इलेक्ट्रॉन संरूपण | 2,8,1 | 2,4 | 2,8,2 | 2,8,7 |
| संयुजा इलेक्ट्रॉन संख्या | 1 | 4 | 2 | 7 |
| संयुजा | 1 | 4 | 2 | 1 |
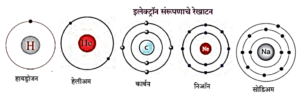
संयुजा व इलेक्ट्रॉन संरूपण यातील सबध :
अणूच्या संयुजेचा संबंध अणूमधील संयुजा इलेक्ट्रॉनांच्या संख्येशी असल्याचे दिसून येते. उदाहरण :
- हेलिअम व निऑन ह्या दोन्ही वायुरूप मूलद्रव्यांचे अणू इतर कोणत्याही अणूबरोबर संयोग पावत नाहीत. ही मूलद्रव्ये रासायनिक दृष्ट्या निष्क्रीय आहेत. म्हणजेच त्यांची संयुजा 'शून्य' आहे.
- हेलिअमच्या अणूत दोन इलेक्ट्रॉन असतात व ते 'K' ह्या पहिल्या कवचात सामावलेले असतात.
- हेलिअममध्ये इलेक्ट्रॉन असलेले फक्त एकच 'K' कवच आहे व तेच बाह्यतम कवचसुध्दा आहे. 'K' कवचाची इलेक्ट्रॉन धारकता (2n2) ही 'दोन' आहे म्हणजेच हेलिअमचे बाह्यतम कवच पूर्ण भरलेले असते. ह्यालाच हेलिअममध्ये इलेक्ट्रॉन द्विक असते असे म्हणतात.
- निऑन ह्या निष्क्रीय वायूच्या इलेक्ट्रॉन संरूपणात 'K' व 'L' ही दोन कवचे असून 'L' हे संयुजा कवच आहे.
- 'L' कवचाची इलेक्ट्रॉन धारकता 'आठ' आहे म्हणजेच निऑनचे संयुजा कवच पूर्ण भरलेले आहे. यालाच निऑनमध्ये इलेक्ट्रॉन अष्टक आहे असे म्हणतात.
- K, L व M या कवचांमध्ये इलेक्ट्रॉन असलेला निष्क्रिय वायू म्हणजे अरगॉन होय.
- M या कवचाची इलेक्ट्रॉन धारकता 2 x 32 =18 आहे. परंतु अरगॉनमध्ये M या संयुजा कवचात फक्त 8 इलेक्ट्रॉन आहेत याचा अर्थ निष्क्रिय वायूंच्या संयुजा कवचात आठ इलेक्ट्रॉन असतात, म्हणजेच संयुजा कवचात इलेक्ट्रॉन अष्टक असते.
- इलेक्ट्रॉन अष्टक (किंवा द्विक) पूर्ण असते तेव्हा संयुजा शून्य असते.
- निष्क्रिय वायू वगळता इतर सर्व मूलद्रव्यांच्या अणूंमध्ये इतर अणूंबरोबर संयोग पावण्याची प्रवृत्ती असते, म्हणजेच त्यांची संयुजा शून्य नसते.
- हायड्रोजनच्या संयोगाने तयार झालेल्या रेणूंच्या सूत्रांवरून (उदा., H2, HCl) हायड्रोजनची संयुजा 'एक' आहे.
- हायड्रोजनच्या इलेक्ट्रॉन संरूपणावरून दिसते की हायड्रोजनमध्ये एक इलेक्ट्रॉन 'K' या कवचात आहे, म्हणजे हायड्रोजनमध्ये 'पूर्ण द्विक' स्थितीपेक्षा एक इलेक्ट्रॉन कमी आहे. ही 'एक' संख्या हायड्रोजनच्या संयुजेशी जुळते.
- सोडिअमच्या 2, 8, 1 या संरूपणावरून समजते की सोडिअमच्या संयुजा कवचात 'एक' इलेक्ट्रॉन आहे आणि NaCl, NaH अशा रेणुसूत्रांवरून समजते की सोडिअमची संयुजा 'एक' आहे.
याचा अर्थ असा आहे की, मूलद्रव्यांची संयुजा व त्यांच्या संयुजा कवचातील इलेक्ट्रॉन संख्या यांत काहीतरी संबंध आहे.
समस्थानिके (Isotopes) :
मूलद्रव्यांमध्ये अणुअंक समान परंतु भिन्न अणुवस्तुमानांक असलेल्या अणूंना समस्थानिके म्हणतात.
उदा. कार्बन : कार्बनची तीन समस्थानिके आहेत. C - 12, C - 13, C - 14 समस्थानिकांचा अणुवस्तु मानांक 12C, 13C व 14C ह्या पध्दतीने दर्शवितात. समस्थानिकांची प्रोटॉन संख्या समान असते परंतु न्यूट्रॉन संख्या भिन्न असते.
| समस्थानिके | अणुवस्तुमानांक A | प्रोटॉन संख्या
Z (अणुअंक) |
न्यूट्रॉन संख्या
n = A - Z |
| 12C | 12 | 6 | 6 |
| 13C | 13 | 6 | 7 |
| 14C | 14 | 6 | 8 |
समस्थानिकांचे उपयोग :
- युरेनिअम-235 चा उपयोग केंद्रकीय विखंडन व ऊर्जानिर्मितीसाठी होतो.
- कॅन्सरसारख्या प्राणघातक आजारांवरील वैद्यकीय उपचारांमध्ये काही मूलद्रव्यांच्या किरणोत्सारी समस्थानिकांचा उपयोग होतो. उदा., कोबाल्ट-
- गॉयटर या थायरॉईड ग्रंथीच्या आजारावरील उपचारांमध्ये आयोडीन-131 चा उपयोग होतो.
- किरणोत्सारी मूलद्रव्यांच्या समस्थानिकांचा उपयोग जमिनीखालून गेलेल्या नळांमधील चिरा शोधण्यासाठी होतो. उदा., सोडिअम-
- अन्नपदार्थांचे सूक्ष्म जीवाणूंपासून परिरक्षण करण्यासाठी किरणोत्सारी मूलद्रव्यांचा उपयोग होतो.
- C-14 या किरणोत्सारी समस्थानिकाचा उपयोग जीवाश्मांचे वय ठरवण्यासाठी होतो.
अणुभट्टी (Nuclear Reactor) :
अणुभट्टी ही अणुऊर्जेच्या वापराने मोठ्या प्रमाणावर वीजनिर्मिती करण्याचे संयंत्र आहे.
अणुभट्टीमध्ये अणुइंधनावर केंद्रकीय अभिक्रिया घडवून आणतात व अणूमधील केंद्रकीय ऊर्जा मुक्त करतात.
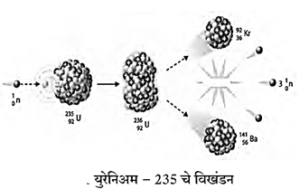
- अणुभट्टीमध्ये युरेनिअम-235 सारख्या अणुइंधनावर मंदगती न्यूट्रॉन्सचा मारा केला असता त्याच्या केंद्रकाचे विखंडन होते.
- या प्रक्रियेत क्रिप्टॉन-92 व बेरिअम-141 अथवा इतर मूलद्रव्यांची केंद्रके व 2 ते 3 वेगवान न्यूट्रॉन्स निर्माण होतात. या न्यूट्रॉन्सची गती ग्राफाइट किंवा जड पाणी वापरून कमी करतात. त्यानंतर ते न्यूट्रॉन्स आणखी U-235 कंद्रकावर आदळल्यावर त्याचेही विखंडन होते.
- अशा प्रकारे केंद्रकीय विखंडनाची शृंखला अभिक्रिया होऊन मोठ्या प्रमाणावर केंद्रकीय ऊर्जा, म्हणजेच अणुऊर्जा मुक्त होते.
- ही शृंखला अभिक्रिया नियंत्रित करण्यासाठी न्यूट्रॉन्सचा वेग व संख्या कमी करण्याची आवश्यकता असते. न्यूट्रॉन्स शोषून त्यांची संख्या कमी करण्यासाठी बोरॉन, कॅड्मिअम,
- बेरिलिअम इत्यादी मूलद्रव्यांच्या कांड्या नियंत्रक म्हणून वापरतात.
- या प्रक्रियेत निर्माण झालेली उष्णता, पाण्याचा शीतक (Coolant) म्हणून वापर करून बाजूला काढली जाते व या उष्णतेने पाण्याची वाफ केली जाते. ती वाफ वापरून टर्बाइन्स चालवतात. त्यामुळे वीजनिर्मिती होते.
भारतामध्ये आठ ठिकाणच्या अणुवीजनिर्मिती केंद्रांमध्ये एकूण बावीस अणुभट्ट्या कार्यान्वित आहेत.
Click on link to get PDF from store
PDF : MSBSHSE-इयत्ता-आठवी – सामान्य विज्ञान-पाठ -5-अणूचे अंतरंग-नोट्स
PDF : MSBSHSE-इयत्ता-आठवी – सामान्य विज्ञान-पाठ -5-अणूचे अंतरंग-स्वाध्याय प्रश्नोत्तरे
Useful links :
| Main Page : - Maharashtra Board इयत्ता-आठवी – सामान्य विज्ञान - All chapters notes, solutions, videos, test, pdf.
Previous Chapter : पाठ - 4 : धाराविद्युत आणि चुंबकत्व - Online Notes Next Chapter : पाठ - 6 : द्रव्याचे संघटन - Online Notes |
