धातु-अधातु
इयत्ता-आठवी – सामान्य विज्ञान-पाठ -7- Maharashtra Board
नोट्स
|
अभ्यासघटक :
|
सर्व वस्तू किंवा पदार्थ हे मूलद्रव्ये, संयुगे, किंवा त्यांच्या मिश्रणांपासून बनलेले आहेत.
मूलद्रव्यांची तीन प्रकारांत विभागणी करतात. धातू, अधातू आणि धातुसदृश.
धातू (Metals) :
धातू : सोने, चांदी, लोखंड, तांबे, ॲल्युमिनिअम, मॅग्नेशिअम, कॅल्शिअम, सोडिअम, प्लॅटिनम.
धातूंचे भौतिक गुणधर्म (Physical Properties of Metals) :
- तेज (Lustre)(चकाकी) : धातूंना चकाकी असते.
- कठीणपणा (Hardness) : सर्वसाधारणपणे धातू कठीण असतात. ते मऊ नसतात. अपवाद - सोडिअम व पोटॅशिअम मऊ असतात व ते चाकूने सहज कापता येतात.
- वर्धनीयता (Malleability) : धातू वर्धनीय असतात, त्यांवर घाव घालून त्यांचा पातळ पत्रा करता येतो.
- तन्यता (Ductility) : धातूंना तन्यता असते, त्यांच्यापासन बारीक तार काढता येते. प्लॅटिनम, सोने हे धातू तन्य म्हणून प्रसिद्ध आहेत.
- उष्णतेचे वहन (Conduction of Heat) : बहुतेक सर्व धातू हे उष्णतेचे सुवाहक असतात. चांदी, तांबे, ॲल्युमिनिअम उष्णतेचे उत्तम वाहक आहेत.
- विद्युत वहन (Conduction of Electricity): बहुतेक सर्व धातू हे विद्युत सुवाहक असतात. अपवाद शिसे हा एकमेव धातू आहे जो उष्णता आणि वीज यांचा सुवाहक नाही.
- अवस्था (Physical State) : सामान्य तापमानावर, धातू स्थायू अवस्थेत असतात. अपवाद - पारा हा द्रव अवस्थेत असतो.
- घनता (Density) : घातूंची घनता उच्च असते. अपवाद सोडि अम, पोटॅशिअम व लिथिअमची घनता पाण्यापेक्षा कमी असते. लिथिअमची घनता53 g/cc इतकीच आहे.
- द्रवणांक व उत्कलनांक (Melting & Boiling Points) : धातूंचे द्रवणांक व उत्कलनांक जास्त असतात. अपवाद Hg, Ga, Na, K.
- नादमयता (Sonority) : धातू नादमय असतात.
अधातू (Non-metals) :
अधातू : क्लोरीन, आयोडीन, ऑक्सिजन.
अधातूंचे भौतिक गुणधर्म (Physical Properties of non-metals) :
- तेज (Lustre)(चकाकी) : अधातूंना चकाकी नसते. अपवाद - हिरा, आयोडिनचे स्फटिक. काही अधातू रंगहीन तर काहींना विविध रंग असतात.
- ठिसूळपणा (Brittleness) : स्थायुरूप अधातू ठिसूळ असतात. काही अधातू मऊ असतात. अपवाद - हिरा (कार्बनचे अपरूप) सर्वांत कठीण नैसर्गिक पदार्थ.
- तन्यता व वर्धनीयता (Ductility & Malleability) : अधातू ठिसूळ असल्याने वर्धनीय नसतात, त्यांना तन्यता नसते.
- उष्णता व विद्युतवहन (Conduction of Heat & Electricity) : अधातू उष्णता व विजेचे दुर्वाहक असतात. अपवाद ग्रॅफाईट (कार्बनचे अपरूप) विजेचा उत्तम सुवाहक आहे.
- अवस्था (Physical State) : अधातू सामान्य तापमानावर, स्थायू किंवा वायू अवस्थेत असतात. अपवाद ब्रोमीन द्रव अवस्था.
- घनता (Density) : सर्वसाधारणपणे अधातूंची घनता कमी असते.
- द्रवणांक व उत्कलनांक (Melting & Boiling Points) : अधातूंचे द्रवणांक व उत्कलनांक कमी असतात. अपवाद कार्बन, बोरॉन हे स्थायू अधातू असून उच्च तापमानाला वितळतात.
धातुसदृश (Metalloids) :
- काही मूलद्रव्यांना धातू आणि अधातू यांच्या दरम्यानचे गुणधर्म असतात. अशा मूलद्रव्यांना धातुसदृश असे म्हणतात.
- आर्सेनिक (As), सिलिकॉन (Si), जर्मेनिअम (Ge), अंटिमनी (Sb) यांसारख्या काही मूलद्रव्यांना धातू आणि अधातू यांच्या दरम्यानचे गुणधर्म असतात.
धातूंचे रासायनिक गुणधर्म (Chemical properties of Metals) :
(i) इलेक्ट्रॉन संरूपण : बहुसंख्य धातूंच्या अणूंच्या बाह्यतम कवचातील इलेक्ट्रॉनची संख्या कमी म्हणजे तीन पर्यंत असते.
| मूलद्रव्य | अणुअंक | इलेक्ट्रॉन संरूपण |
| 11Na | 11 | 2, 8, 1 |
| 12Mg | 12 | 2, 8, 2 |
| 13 Al | 13 | 2, 8, 3 |
(ii) आयनांची निर्मिती : धातूंमध्ये त्यांचे संयुजा इलेक्ट्रॉन गमावून धनप्रभारी आयन, धन-आयन म्हणजेच 'कॅटायन' निर्माण करण्याची प्रवृत्ती असते.

(iii) ऑक्सिजनबरोबर अभिक्रिया : धातूंचा ऑक्सिजनशी संयोग होऊन त्यांची ऑक्साइडे तयार होतात.
धातू + ऑक्सिजन → धातूचे ऑक्साइड
धातूंची ऑक्साइडे आम्लारिधर्मी असतात. धातूंच्या ऑक्साइडची अभिक्रिया आम्लासोबत होऊन क्षार आणि पाणी तयार होते.
धातूंचे ऑक्साइड + आम्ल → क्षार +पाणी
(iv) आम्लाबरोबर अभिक्रिया : बहुतेक धातूंची विरल आम्लांबरोबर अभिक्रिया होऊन धातूंचे क्षार तयार होतात व हायड्रोजन वायू बाहेर पडतो.
धातू + विरल आम्ल → क्षार + हायड्रोजन वायू
(v) पाण्यासोबत अभिक्रिया : काही धातूंची पाण्यासोबत अभिक्रिया होऊन हायड्रोजन वायूची निर्मिती होते. काही धातूंची पाण्याबरोबर कक्ष तापमानाला, काहींची गरम पाण्यासोबत, तर काहींची पाण्याच्या वाफेसोबत अभिक्रिया होते, त्यांच्या अभिक्रियेचा दर वेगवेगळा असतो.
अधातूंचे रासायनिक गुणधर्म (Chemical properties of non-metals) :
(i) इलेक्ट्रॉनी संरूपण : बहुसंख्य अधातूंच्या संयुजा कवचातील इलेक्ट्रॉनची संख्या जास्त म्हणजे 4 ते 7 पर्यंत असते.
| मूलद्रव्य | अणुअंक | इलेक्ट्रॉन संरूपण |
| 7N | 7 | 2, 5 |
| 8O | 8 | 2, 6 |
| 17 Cl | 17 | 2, 8, 7 |
(ii) आयनांची निर्मिती : अधातूंमध्ये त्यांच्या संयुजा कवचात इलेक्ट्रॉन स्वीकारून ऋण प्रभारी आयन, ऋणआयन म्हणजेच 'अॅनायन' निर्माण करण्याची प्रवृत्ती असते.
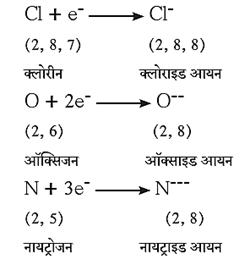
(iii) ऑक्सिजनबरोबर अभिक्रिया : अधातू ऑक्सिजनशी संयोग करून त्यांची ऑक्साइडे तयार करतात.
अधातू + ऑक्सिजन → अधातूचे ऑक्साइड
अधातूंची ऑक्साइडे ही आम्लधर्मी असतात. ती आम्लारीशी संयोग पावून द्रावणीय क्षार व पाणी तयार करतात.
C + O2 → CO2
CO2 + 2NaOH → Na2CO3 + H2O
अधातूंचे ऑक्साइड पाण्यासोबत अभिक्रिया करून आम्ल तयार करतात.
CO2 + H2O → H2CO3 कार्बोनिक आम्ल
SO2 + H2O → H2SO3 सल्फ्युरस आम्ल
SO3 + H2O → H2SO4 सल्फ्युरिक आम्ल
(iv) अधातूंची विरल आम्ला सोबत अभिक्रिया होत नाही :
धातू व अधातूंचे उपयोग :
राजधातू (Nobel Metal) :
सोने, चांदी, प्लॅटिनम, पॅलेडिअम व व्होडिअम यांसारखे काही धातू राजधातू आहेत. ते निसर्गात मूलद्रव्यांच्या स्वरूपात आढळतात. त्यांच्यावर हवा, पाणी, उष्णता यांचा सहजपणे परिणाम होत नाही. त्यांची क्षरण व ऑक्सिडीकरण अभिक्रिया ही कक्ष तापमानाला होत नाही.
राजधातूंचे उपयोग :
- सोने, चांदी व प्लॅटिनम यांचा वापर मुख्यतः अलंकार बनवण्यासाठी होतो.
- चांदीचा उपयोग औषधीमध्ये होतो. (Antibacterial property).
- सोन्या-चांदीची पदकेही तयार करतात.
- काही इलेक्ट्रॉनिक उपकरणात चांदी, सोने यांचा उपयोग होतो.
- प्लॅटिनम, पॅलेडिअम या धातूंचा उपयोग उत्प्रेरक (Catalyst) म्हणून सुद्धा होतो.
सोन्याची शुद्ंधता (Purity of Gold) :
सोने हा एक राजधातू असून सोने निसर्गात मूलद्रव्य स्वरूपात आढळते. 100 टक्के शुद्ध सोने म्हणजे 24 कॅरेट सोने.
शुद्ध सोने मऊ असते. त्यामुळे शुद्ध सोन्याने तयार केलेले दागिने दाबामुळे वाकतात किंवा तुटतात. म्हणून त्यात सोनार तांबे किंवा चांदी विशिष्ट प्रमाणात मिसळतात. दागिने तयार करण्यासाठी 22 कॅरेट किंवा त्याहून कमी कॅरेटचे सोने वापरतात.
क्षरण (Corrosion) :
धातूंवर ओलाव्यामुळे हवेतील वायूंची प्रक्रिया होऊन धातूंची संयुगे तयार होतात. या प्रक्रियेमुळे धातूंवर परिणाम होऊन ते झिजतात. यालाच क्षरण असे म्हणतात.
- धातूंचे क्षरण होऊ नये म्हणून त्यांच्यावर तेल, ग्रीस, वारनिश, व रंगाचे थर दिले जाते. तसेच दुसऱ्या न गंजणाऱ्या धातूचा मुलामा दिला जातो.
- या क्रियांमुळे धातूंच्या पृष्ठभागाचा हवेपासून संपर्क तुटतो व त्यामुळे रासायनिक अभिक्रिया घडू न शकल्याने क्षरण होत नाही.
- लोखंडावर जस्ताचा मुलामा देऊन लोखंडाचे क्षरण थांबवता येते.
दैनंदिन जीवनातील क्षरणाची उदाहरणे :
- लोखंडावर ऑक्सिजन वायूची अभिक्रिया होऊन तांबूस रंगाचा लेप तयार होतो.
- तांब्यावर कार्बन डायऑक्साइड वायूची अभिक्रिया होऊन हिरवट रंगाचा लेप तयार होतो. चांदीवर हायड्रोजन सल्फाइड वायूची अभिक्रिया होऊन काळ्या रंगाचा लेप तयार होतो.
संमिश्रे (Alloy) :
- दोन किंवा अधिक धातूंच्या किंवा धातू व अधातूंच्या एकजीव (समांगी) मिश्रणाला संमिश्र असे म्हणतात.
- संमिश्रातील धातूंचे प्रमाण विशिष्ट असते.
- संमिश्र तयार झाल्यावर त्याचे भौतिक गुणधर्म बदलतात, परंतु रासायनिक गुणधर्म तसेच राहतात.
उदा. :
- तांबे व टिन यांच्या मिश्रणातून ब्राँझ हे संमिश्र तयार होते. हे कठीण व गंजरोधक आहे.
- लोखंड व कार्बन यांच्या मिश्रणातून पोलाद हे संमिश्र तयार होते. हे मजबूत आहे.
- लोखंड, कार्बन, क्रोमिअम आणि निकेल यांपासून स्टेनलेस स्टील हे संमिश्र मिळते. ते अधिक स्वच्छ व टिकाऊ असते. त्यावर गंजण्याची क्रिया होत नाही.
- पितळ हे संमिश्र तांबे व जस्त यांपासून बनवतात.
- कांस्य हे संमिश्र तांबे व कथिल यांच्यापासून बनवतात.
Click on link to get PDF from store
PDF : MSBSHSE-इयत्ता-आठवी – सामान्य विज्ञान-पाठ-7-धातु-अधातु - नोट्स
PDF : MSBSHSE-इयत्ता-आठवी – सामान्य विज्ञान-पाठ-7-धातु-अधातु - स्वाध्याय प्रश्नोत्तरे
Useful links :
| Main Page : - Maharashtra Board इयत्ता-आठवी – सामान्य विज्ञान - All chapters notes, solutions, videos, test, pdf.
Previous Chapter : पाठ - 6 : द्रव्याचे संघटन - Online Notes Next Chapter : पाठ - 8 : प्रदूषण - Online Notes |
