अणूचे अंतरंग
इयत्ता-आठवी – सामान्य विज्ञान-पाठ -5- Maharashtra Board
स्वाध्याय प्रश्नोत्तरे
प्रश्न 1. खालील प्रश्नांची उत्तरे लिहा.
(अ) थॉमसन व रूदरफोर्ड यांच्या अणुप्रारूपांत कोणता फरक आहे ?
| थॉमसन अणुप्रारूप | रूदरफोर्ड अणुप्रारूप |
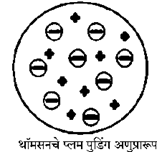
| थॉमसनच्या अणुप्रारूपानुसार अणूमध्ये सर्वत्र धनप्रभारयुक्त जेल पसरलेला असतो व त्यामध्ये ऋणप्रभारित इलेक्ट्रॉन जडवलेले असतात. | रुदरफोर्डच्या अणुप्रारूपामध्ये केंद्रकाभोवती ऋणप्रभारित इलेक्ट्रॉनचे कण परिभ्रमण करतात. |
| अणू हा एकजिनसी धनप्रभारित गोल आहे. | अणूच्या केंद्रभागी धनप्रभारित केंद्रक असते. |
(आ) मूलद्रव्यांची संयुजा म्हणजे काय ? संयुजा इलेक्ट्रॉन संख्या व संयुजा यांच्यातील संबंध काय ते लिहा.
संयुजा : मूलद्रव्याच्या इतर मूलद्रव्यांशी संयोग पावण्याच्या क्षमतेला संयुजा म्हणतात.
संयुजा व इलेक्ट्रॉन संरूपण यातील सबध :
अणूच्या संयुजेचा संबंध अणूमधील संयुजा इलेक्ट्रॉनांच्या संख्येशी असल्याचे दिसून येते. उदाहरण :
- हेलिअम व निऑन ह्या दोन्ही वायुरूप मूलद्रव्यांचे अणू इतर कोणत्याही अणूबरोबर संयोग पावत नाहीत. ही मूलद्रव्ये रासायनिक दृष्ट्या निष्क्रीय आहेत. म्हणजेच त्यांची संयुजा 'शून्य' आहे.
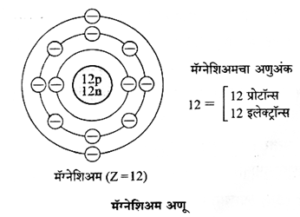
- हेलिअमच्या अणूत दोन इलेक्ट्रॉन असतात व ते 'K' ह्या पहिल्या कवचात सामावलेले असतात.
- हेलिअममध्ये इलेक्ट्रॉन असलेले फक्त एकच 'K' कवच आहे व तेच बाह्यतम कवचसुध्दा आहे. 'K' कवचाची इलेक्ट्रॉन धारकता (2n2) ही 'दोन' आहे म्हणजेच हेलिअमचे बाह्यतम कवच पूर्ण भरलेले असते. ह्यालाच हेलिअममध्ये इलेक्ट्रॉन द्विक असते असे म्हणतात.
- निऑन ह्या निष्क्रीय वायूच्या इलेक्ट्रॉन संरूपणात 'K' व 'L' ही दोन कवचे असून 'L' हे संयुजा कवच आहे.
- 'L' कवचाची इलेक्ट्रॉन धारकता 'आठ' आहे म्हणजेच निऑनचे संयुजा कवच पूर्ण भरलेले आहे. यालाच निऑनमध्ये इलेक्ट्रॉन अष्टक आहे असे म्हणतात.
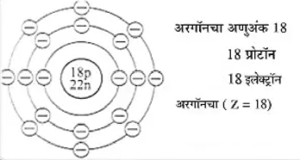
- K, L व M या कवचांमध्ये इलेक्ट्रॉन असलेला निष्क्रिय वायू म्हणजे अरगॉन होय.
- M या कवचाची इलेक्ट्रॉन धारकता 2 x 32 =18 आहे. परंतु अरगॉनमध्ये M या संयुजा कवचात फक्त 8 इलेक्ट्रॉन आहेत याचा अर्थ निष्क्रिय वायूंच्या संयुजा कवचात आठ इलेक्ट्रॉन असतात, म्हणजेच संयुजा कवचात इलेक्ट्रॉन अष्टक असते.
- इलेक्ट्रॉन अष्टक (किंवा द्विक) पूर्ण असते तेव्हा संयुजा शून्य असते.
- निष्क्रिय वायू वगळता इतर सर्व मूलद्रव्यांच्या अणूंमध्ये इतर अणूंबरोबर संयोग पावण्याची प्रवृत्ती असते, म्हणजेच त्यांची संयुजा शून्य नसते.
- हायड्रोजनच्या संयोगाने तयार झालेल्या रेणूंच्या सूत्रांवरून (उदा., H2, HCl) हायड्रोजनची संयुजा 'एक' आहे.
- हायड्रोजनच्या इलेक्ट्रॉन संरूपणावरून दिसते की हायड्रोजनमध्ये एक इलेक्ट्रॉन 'K' या कवचात आहे, म्हणजे हायड्रोजनमध्ये 'पूर्ण द्विक' स्थितीपेक्षा एक इलेक्ट्रॉन कमी आहे. ही 'एक' संख्या हायड्रोजनच्या संयुजेशी जुळते.
- सोडिअमच्या 2, 8, 1 या संरूपणावरून समजते की सोडिअमच्या संयुजा कवचात 'एक' इलेक्ट्रॉन आहे आणि NaCl, NaH अशा रेणुसूत्रांवरून समजते की सोडिअमची संयुजा 'एक' आहे.
याचा अर्थ असा आहे की, मूलद्रव्यांची संयुजा व त्यांच्या संयुजा कवचातील इलेक्ट्रॉन संख्या यांत काहीतरी संबंध आहे.
(इ) अणुवस्तु मानांक म्हणजे काय ? कार्बनचा अणुअंक 6 तर अणुवस्तुमानांक 12 आहे. हे कसे ते स्पष्ट करा.
अणूमधील प्रोटॉन व न्यूट्रॉन यांची एकत्र संख्या म्हणजे त्या मूलद्रव्याचा अणुवस्तुमानांक होय. तो 'A' या संज्ञेने दर्शवतात.
कार्बनचा अणुअंक 6 म्हणजेच प्रोटॉनची संख्या 6 आहे व कार्बनचा अणुवस्तुमानांक 12 आहे यावरून कार्बनच्या केंद्रकात (A - Z) = (12 - 6) = 6 न्यूट्रॉन आहेत.
कार्बनचा अणुवस्तुमानांक = 6 प्रोटॉन्स + 6 न्यूट्रॉन्स = 12
कार्बनचा अणुअंक 6 व अणुवस्तुमानांक 12 आहे.
(ई) अवअणुकण म्हणजे काय? विद्युतप्रभार, वस्तुमान व स्थान ह्या संदर्भात तीन अवअणुकणांची
थोडक्यात माहिती लिहा.
जो कण अणूचा एक भाग असतो आणि अणूपेक्षाही लहान असतो; अशा कणाला अवअणुकण म्हणतात.
केंद्रक व केंद्रकाबाहेरील भाग यांचा मिळून अणू बनतो. यांच्यामध्ये तीन प्रकारच्या अवअणुकणांचा समावेश असतो. केंद्रकामध्ये दोन प्रकारचे अवअणुकण असतात. एकत्रितपणे त्यांना न्युक्लिऑन म्हणतात. प्रोटॉन व न्यूट्रॉन हे न्यूक्लिऑनचे दोन प्रकार आहेत. इलेक्ट्रॉन हा अवअणुकण असून केंद्राबाहेरील भागात असतो.
प्रोटॉन (p) : प्रोटॉन हा अणुकेंद्रकात असणारा धनप्रभारित अवअणुकण असून केंद्रकावरील धनप्रभार हा त्याच्यातील प्रोटॉनमुळे असतो. प्रोटॉनचा निर्देश 'p' या संज्ञेने करतात.
प्रत्येक प्रोटॉनवरील धनप्रभार +1 e एवढा असतो. (1 e = 1.6 x 10-19 कूलोम) त्यामुळे केंद्रकावरील एकूण धनप्रभार 'e' या एककामध्ये व्यक्त केल्यास त्याचे परिमाण
केंद्रकातील प्रोटॉनसंख्येएवढे असते. एका प्रोटॉनचे वस्तुमान सुमारे 1u (unified mass) इतके असते.
न्यूट्रॉन (n) : न्यूट्रॉन हा विद्युतप्रभारदृष्ट्या उदासीन असलेला अवअणुकण असून त्याचा निर्देश 'n' या संज्ञेने करतात. केंद्रकातील न्यूट्रॉन संख्येसाठी 'n' ही संज्ञा वापरतात.
1u इतके अणुवस्तुमान असलेल्या हायड्रोजनचा अपवाद वगळता सर्व मूलद्रव्यांच्या अणुकेंद्रकांमध्ये न्यूट्रॉन असतात. एका न्यूट्रॉनचे वस्तुमान सुमारे 1u इतके आहे, म्हणजेच जवळजवळ प्रोटॉनच्या वस्तुमानाइतकेच आहे.
इलेक्ट्रॉन (e) : इलेक्ट्रॉन हा ऋणप्रभारित अवअणुकण असून त्याचा निर्देश 'e-' या संज्ञेने करतात. प्रत्येक इलेक्ट्रॉनवर एक एकक ऋणप्रभार (-1 e) असतो. इलेक्ट्रॉनचे वस्तुमान हायड्रोजन अणूच्या वस्तुमानापेक्षा 1800 पटींनी कमी आहे. त्यामुळे इलेक्ट्रॉनचे वस्तुमान नगण्य मानता येते. अणूच्या केंद्रकाबाहेरील भागातील इलेक्ट्रॉन हे केंद्रकाभोवती असलेल्या वेगवेगळ्या कक्षांमध्ये परिभ्रमण करतात. भ्रमणकक्षेचे स्वरूप त्रिमित असल्याने 'कक्षा' या पदाऐवजी 'कवच' (shell) हे पद वापरतात. इलेक्ट्रॉनची ऊर्जा तो ज्या कवचात असतो त्यावरून ठरते.
प्रश्न 2. शास्त्रीय कारणे लिहा.
(अ) अणूचे सगळे वस्तुमान केंद्रकात एकवटलेले असते.
- अणूच्या केंद्रस्थानी असलेल्या केंद्रकात धनप्रभार असतो व केंद्रकात प्रोटॉन व न्यूट्रॉन असतात.
- इलेक्ट्रॉनचे वस्तुमान प्रोटॉन व न्यूट्रॉन यांच्या वस्तुमानांच्या तुलनेत नगण्य असते. तसेच अणूचे एकूण वस्तुमान केंद्रकातील प्रोटॉन व न्यूट्रॉनच्या संख्येवर अवलंबून
- असते. त्यामुळे अणूचे सगळे वस्तुमान केंद्रकात एकवटलेले असते.
(आ) अणू विद्युतदृष्ट्या उदासीन असतो.
- अणूच्या केंद्रकात धनप्रभारित प्रोटॉन्स असतात, तर केंद्रकाबाहेरील भाग ऋणप्रभारित इलेक्ट्रॉन्स आणि खूप मोकळी जागा यांनी व्यापलेला असतो. कोणत्याही अणूमध्ये प्रोटॉनच्या संख्येइतकेच इलेक्ट्रॉन्स असतात.
- केंद्रकाबाहेरील सर्व इलेक्ट्रॉन्सवरील एकूण ऋणप्रभार हा केंद्रकातील एकूण धनप्रभाराएवढा असल्याने अणू हा विद्युतदृष्ट्या उदासीन असतो.
(इ) अणुवस्तुमानांक पूर्णांकात असते.
- अणूमधील प्रोटॉन्स व न्यूट्रॉन्स यांच्या एकत्रित संख्येला त्या मूलद्रव्याचा अणुवस्तुमानांक (A) म्हणतात.
- प्रोटॉन्स आणि न्यूट्रॉन्स पूर्णांकांत असल्यानेच अणुवस्तुमानांक सुद्धा पूर्णाकात असते.
(ई) परिभ्रमण करणारे प्रभारित इलेक्ट्रॉन असूनही सामान्यपणे अणंना स्थायीभाव असतो.
- अणूचे एकूण वस्तुमान केंद्रकातील प्रोटॉन व न्यूट्रॉनच्या संख्येवर अवलंबून असते. त्यामुळे अणूचे सगळे वस्तुमान धनप्रभारित केंद्रकात एकवटलेले असते.
- ऋणप्रभारित इलेक्ट्रॉन्स केंद्रकाभोवती कक्षामध्ये परिभ्रमण करतात.
- केंद्रकाबाहेरील इलेक्ट्रॉन्सवरील एकूण ऋणप्रभार हा केंद्रकावरील धनप्रभाराने संतुलित राहतो म्हणजे अणूला स्थायीभाव प्राप्त होतो.
प्रश्न 3. व्याख्या लिहा.
(अ) अणू
सर्व भौतिक व रासायनिक बदलांमध्ये आपली रासायनिक ओळख कायम राखणारा मूलद्रव्याचा लहानात लहान कण म्हणजे अणू होय. अणू हे द्रव्याचे सर्वांत लहान एकक आहे.
(ब) समस्थानिके
एकाच मूलद्रव्याच्या ज्या अणूंचे अणुअंक सारखे असून त्यांचे अणुवस्तुमानांक मात्र भिन्न असतात, अशा अणूंना त्या मूलद्रव्यांची समस्थानिके म्हणतात.
(क) अणुअंक
अणुअंक (Z) : अणूमधील इलेक्ट्रॉन किंवा प्रोटॉनच्या संख्येला त्या अणूचा अणुअंक म्हणतात. त्याचा Z या अक्षराने निर्देश करतात.
(ड) अणुवस्तुमानांक
मूलद्रव्याच्या अणूतील केंद्रकात असणाऱ्या प्रोटॉन (p) आणि न्यूट्रॉन (n) यांच्या एकत्रित संख्येला त्या मूलद्रव्याचा अणुवस्तुमानांक म्हणतात. त्याचा A या अक्षराने निर्देश करतात.
(इ) अणुभट्टीतील मंदक
अणुभट्टीमध्ये निर्माण होणाऱ्या वेगवान न्यूट्रॉन्सचा वेग कमी करण्यासाठी जो पदार्थ वापरतात त्याला मंदक म्हणतात.
प्रश्न 4. सुबक व नामनिर्देशित आकृती काढा.
(अ) रूदरफोर्डचा विकीरण प्रयोग
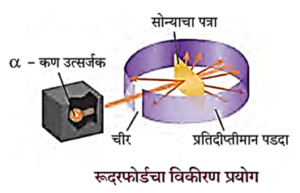
(आ) थॉमसनचे अणुप्रारूप
(इ) मॅग्नेशिअमच्या (अणुअंक 12) इलेक्ट्रॉन संरूपणाचे रेखाटन
(ई) अरगॉनच्या (अणुअंक 18) इलेक्ट्रॉन संरूपणाचे रेखाटन
प्रश्न 5. रिकाम्या जागा भरा.
(अ) इलेक्ट्रॉन, प्रोटॉन, न्यूट्रॉन हे अणूमध्ये असणारे ……. आहेत.
इलेक्ट्रॉन, प्रोटॉन, न्यूट्रॉन हे अणूमध्ये असणारे अवअणुकण आहेत.
(आ) इलेक्ट्रॉनवर …… प्रभार असतो.
इलेक्ट्रॉनवर ऋण प्रभार असतो
(इ) अणुकेंद्रकापासून सर्वांत जवळचे इलेक्ट्रॉन कवच …….. हे आहे.
अणुकेंद्रकापासून सर्वांत जवळचे इलेक्ट्रॉन कवच K हे आहे.
(ई) मॅग्नेशिअमचे इलेक्ट्रॉन संरूपण 2, 8, 2 आहे. यावरून असे समजते की मॅग्नेशिअमचे संयुजा कवच …….. हे आहे.
मॅग्नेशिअमचे इलेक्ट्रॉन संरूपण 2, 8, 2 आहे. यावरून असे समजते की मॅग्नेशिअमचे संयुजा कवच M हे आहे.
(उ) H2O ह्या रेणुसूत्रानुसार हायड्रोजनची संयुजा 1 आहे. त्यामुळे Fe2O3 ह्या सूत्रानुसार Fe ची
संयुजा …….. ठरते.
H2O ह्या रेणुसूत्रानुसार हायड्रोजनची संयुजा 1 आहे. त्यामुळे Fe2O3 ह्या सूत्रानुसार Fe ची संयुजा 3 ठरते.
प्रश्न 6. जोड्या जुळवा.
‘अ’ गट ‘ब’ गट
अ. प्रोटॉन i. ॠणप्रभारित
आ. इलेक्ट्रॉन ii. उदासीन
इ. न्यूट्रॉन iii. धनप्रभारित
(अ) प्रोटॉन - धनप्रभारित
(आ) इलेक्ट्रॉन - ऋणप्रभारित
(इ) न्यूट्रॉन - उदासीन.
प्रश्न 7. दिलेल्या माहितीवरून शोधून काढा.
| माहिती | शोधा |
| \(_{11}^{23}Na\) | न्यूट्रॉन संख्या |
| \(_{6}^{14}C\) | अणुवस्तु मानांक |
| \(_{17}^{37}Cl\) | प्रोटॉन संख्या |
(1) \(_{11}^{23}Na\) मध्ये न्यूट्रॉन संख्या 12 आहे. (N = A - Z) = 23 - 11 = 12
(2) \(_{6}^{14}C\) चा अणुवस्तुमानांक 14 आहे.
(3) \(_{17}^{37}Cl\) या अणूत 17 प्रोटॉन्स आहेत.
Click on link to get PDF from store
PDF : MSBSHSE-इयत्ता-आठवी – सामान्य विज्ञान-पाठ -5-अणूचे अंतरंग-नोट्स
PDF : MSBSHSE-इयत्ता-आठवी – सामान्य विज्ञान-पाठ -5-अणूचे अंतरंग-स्वाध्याय प्रश्नोत्तरे
Useful links :
| Main Page : - Maharashtra Board इयत्ता-आठवी – सामान्य विज्ञान - All chapters notes, solutions, videos, test, pdf.
Previous Chapter : पाठ - 4 : धाराविद्युत आणि चुंबकत्व - Online Solutions Next Chapter : पाठ - 6 : द्रव्याचे संघटन - Online Solutions |