आम्ल, आम्लारी व क्षार
Marathi Medium-Class 9-विज्ञान आणि तंत्रज्ञान-पाठ-5-Maharashtra Board
स्वाध्याय प्रश्नोत्तरे
प्रश्न 1. गटात न बसणारा शब्द ओळखा व कारण द्या.
(अ) क्लोराइड, नायट्रेट, हायड्राइड, अमोनिअम
अमोनिअम. (अमोनियम एक कॅटायन (धन आयन) आहे आणि बाकीचे आयन अॅनायन (ऋण आयन) आहेत.)
(आ) हायड्रोजन क्लोराइड, सोडिअम हायड्रॉक्साइड, कॅल्शिअम ऑक्साइड, अमोनिआ
हायड्रोजन क्लोराइड. (कारण हायड्रोजन क्लोराईड हे आम्ल आहे आणि इतर सर्व आम्लारिधर्मी संयुगे आहेत.)
(इ) अॅसेटिक अॅसिड, कारबॉनिक अॅसिड, हायड्रोक्लोरीक अॅसिड, नायट्रिक अॅसिड.
अॅसेटिक अॅसिड. (इतर सर्व अकार्बनी अॅसिडस् आहेत.)
(ई) अमोनियम क्लोराइड, सोडिअम क्लोराइड, पोटॅशिअम नायट्रेट, सोडिअम सल्फेट.
अमोनिअम क्लोराइड. (अमोनिअम क्लोराइड हा आम्लधर्मी क्षार आहे, इतर सर्व उदासीन क्षार आहेत.)
(उ) सोडिअम नायट्रेट, सोडिअम कार्बोनेट, सोडिअम सल्फेट, सोडिअम क्लोराइड
सोडिअम कार्बोनेट. (सोडियम कार्बोनेटचे द्रावण आम्लारी आहे. इतर सर्व उदासीन क्षार आहेत.)
(ऊ) कॅल्शिअम ऑक्साइड, मॅग्नेशिअम ऑक्साइड, झिंक ऑक्साइड, सोडिअम ऑक्साइड
झिंक ऑक्साइड उभयधर्मी ऑक्साइड आहे. (इतर सर्व आम्लारिधर्मी ऑक्साइडे आहेत.)
(ए) स्फटिकरूप मोरचूद, स्फटिकरूप मीठ, स्फटिकरूप फेरस सल्फेट, स्फटिकरूप सोडिअम कार्बोनेट
स्फटिकरूप मीठ. (स्फटिकरूप मिठामध्ये स्फटिकजल नसते, इतर सर्व स्फटिकजल आहेत.)
(ऐ) सोडिअम क्लोराइड, पोटॅशिअम हायड्रॉक्साइड, अॅसेटिक अॅसिड, सोडिअम अॅसिटेट.
अॅसेटिक अॅसिड. (इतर सर्व विद्युत अपघटनी पदार्थ आहेत.)
प्रश्न 2. पुढील कृती केल्यावर काय बदल दिसतील ते लिहून त्या मागील कारण स्पष्ट करा.
(अ) कॉपर सल्फेटच्या 50 मिली द्रावणात 50 मिली पाणी मिळवले.
जेव्हा कॉपर सल्फेटच्या 50 मिली द्रावणात 50 मिली पाणी मिसळले, तेव्हा कॉपर सल्फेटच्या द्रावणाची संहती कमी झाली व ते विरल द्रावण झाले. आणि रंग फिकट निळ्यापासून पांढरा होतो आणि पुन्हा त्यात पाणी सोडल्यावर परत निळ्यामध्ये बदलतो.
(आ) सोडिअम हायड्रॉक्स इडच्या 10 मिली द्रावणात फिनॉलफ्थॅलीन दर्शकाचे दोन थेंब टाकले.
- सोडिअम हायड्रॉक्साइडच्या 10 मिली द्रावणात फिनॉल्फ्थॅलीन दर्शकाचे दोन थेंब टाकले असता, द्रावणाला गुलाबी रंग येतो.
- कारण फिनॉल्फ्थॅलीन हे आम्ल व आम्लारी दर्शक आहे. आम्लधर्मीय द्रावणात ते रंगहीन, तर आम्लारिधर्मी द्रावणात ते गुलाबी होते. NaOH हे आम्लारिधर्मी आहे म्हणून त्याचा रंग गुलाबी झाला.
(इ) 10 मिली विरल नायट्रिक अॅसिडमध्ये तांब्याच्या किसाचे 2/3 कण टाकून हलवले
10 मिली विरल नायट्रिक अॅसिडमध्ये तांब्याच्या किसाचे 2/3 कण टाकून हलवले असता कॉपर नायट्रेटचे द्रावण तयार होते व हायड्रोजन वायू मुक्त होतो.
(ई) 2 मिली विरल HCl मध्ये लिटमस कागदाचा तुकडा टाकला. त्यानंतर त्यामध्ये 2 मिली
संहत NaOH मिळवून हलवले.
- 2 मिली विरल HCl मध्ये लिटमस कागदाचा तुकडा टाकला असता निळा लिटमस लाल होतो. जेव्हा त्यामध्ये 2 मिली संहत NaOH मिळवून हलवले असता लाल लिटमस निळा होतो.
- कारण आहे की NaOH हे HCl ला उदासीन करते आणि यातून क्षार आणि पाणी तयार होते. NaOH सोडल्यामुळे तयार झालेल्या शेवटच्या द्रव्यात आम्लारीचे प्रमाण (NaOH) अधिक होते, म्हणजेच लाल लिटमस पेपर निळा होतो.
(उ) विरल HCl मध्ये मॅग्नेशिअम ऑक्साइड मिळवले तसेच विरल NaOH मध्ये मॅग्नेशिअम ऑक्साइड मिळवले.
- विरल HCl मध्ये मॅग्नेशिअम ऑक्साइड मिळवले असता मॅग्नेशिअम क्लोराइड व पाणी तयार होते. त्यात मॅग्नेशिअम ऑक्साइड हे आम्लारिधर्मी आहे. त्यामुळे उदासिनीकरण होते.
- मॅग्नेशिअम ऑक्साइड व विरल NaOH ची अभिक्रिया होत नाही. दोन्हीही आम्लारिधर्मी आहेत.
(ऊ) विरल HCl मध्ये झिंक ऑक्साइड मिळवले तसेच विरल NaOH मध्ये झिंक ऑक्साइड मिळवले.
- झिंक ऑक्साइड HCl मध्ये मिळवले असता झिंक क्लोराइड व पाणी तयार होते. या अभिक्रियेमध्ये झिंक ऑक्साइड हे आम्लारिधर्मी आहे.
- जर विरल NaOH मध्ये झिंक ऑक्साइड मिळवले असता सोडिअम झिंकेट (Na2ZnO2) व पाणी तयार होते. या अभिक्रियेमध्ये झिंक ऑक्साइड हे आम्लधर्मी आहे.
- म्हणून झिंक ऑक्साइड हे उभयधर्मी ऑक्साइड आहे, कारण ते आम्लधर्मी आणि आम्लारिधर्मी गुणधर्म दर्शवते.
(ए) चुनखडीवर विरल HCl टाकले.
चुनखडीवर विरल HCI टाकले असता कॅल्शिअम क्लोराइड, पाणी तयार होते व CO2 वायू मुक्त होतो. या अभिक्रियेत चुनखडी ही आम्लारिधर्मी आहे.
2HCl + CaCO3 → CaCl2 + H2O + CO2
(ऐ) परीक्षानळीत मोरचुदाचे खडे तापवले व थंड झाल्यावर त्यात पाणी मिळवले.
- मोरचुदाचे खडे तापवले असता मोरचुदाची स्फटिक संरचना मोडून रंगहीन (पांढरे) चूर्ण तयार होते व पाण्याचे बाष्प होऊन निघून जाते व थंड झाल्यावर या चूर्णात पाणी ओतले असता पुन्हा निळ्या रंगाचे मोरचूद तयार होते.
- मोरचूद तापवल्याने त्यात कोणतेही रासायनिक बदल घडत नाहीत. पाणी निघून जाणे, स्फटिक संरचना नष्ट होणे, निळा रंग जाणे, पाणी घातल्यावर रंग परत बदलणे. हे सर्व भौतिक बदल दिसतात.
(ओ) विद्युत अपघटनी घटात विरल H2SO4 घेऊन त्यातून वीजप्रवाह जाऊ दिला.
विद्युत अपघटन घटात विरल H2SO4 घेऊन त्यातून विद्युतप्रवाह जाऊ दिल्यावर H2SO4 च्या अपघटनाने ऋणाग्राजवळ हायड्रोजन वायू तयार होतो, तर धनाग्राजवळ ऑक्सिजन वायू मुक्त होतो.
2H(aq) + 2e− → H2(g) ..... ऋणाग्राजवळ
4OH(aq) → 2H2O(l) + O2(g) + 4e− .... धनाग्राजवळ
प्रश्न 3. खालील ऑक्साइडचे तीन गटात वर्गीकरण करून त्यांना नावे द्या.
CaO, MgO, CO2, SO3, Na2O, ZnO, Al2O3, Fe2O3
(i) आम्लारिधर्मी ऑक्साइड : CaO, MgO, Na2O, Fe2O3.
(ii) आम्लधर्मी ऑक्साइड : CO2, SO3.
(iii) उभयधर्मी ऑक्साइड : ZnO, Al2O3.
प्रश्न 4. इलेक्ट्रॉन संरूपण आकृती काढून स्पष्ट करा.
(अ) सोडिअम व क्लोरीनपासून सोडिअम क्लोराइडची निर्मिती
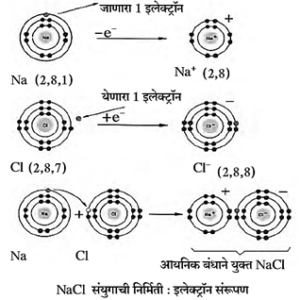
सोडिअम क्लोराइड : सोडिअमच्या अणूमध्ये बाह्यतम कक्षेत 1 इलेक्ट्रॉन असतो, तो देऊन सोडिअमचा धन आयन बनतो. याच वेळी क्लोरीनच्या बाह्यतम कक्षेत हा इलेक्ट्रॉन स्वीकारून क्लोरीनच्या अणूच्या बाह्यतम कक्षेत अष्टक पुरे होते. क्लोरीनचा ऋण आयन तयार होतो. सोडिअमचा धन आयन व क्लोरीनचा ऋण आयन यांमधील विद्युत स्थितिक आकर्षणामुळे त्यांमध्ये आयनिक बंध तयार होऊन सोडिअम क्लोराइड तयार होते.
Na → Na+ + e− ;
(2, 8, 1) (2, 8)
Cl + e− → Cl−
(2, 8, 7) (2, 8, 8)
Na+ + Cl− → NaCl
(आ) मॅग्नेशिअम व क्लोरीनपासून मॅग्नेशिअम क्लोराइडची निर्मिती
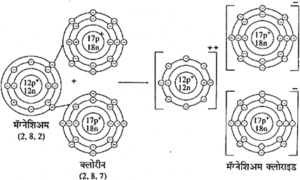
मॅग्नेशिअम क्लोराइड : मॅग्नेशिअमच्या अणूमध्ये बाह्यतम कक्षेत 2 इलेक्ट्रॉन असतात. ते देऊन मॅग्नेशिअमचा दोन धन प्रभार असलेला धन आयन बनतो. क्लोरीन अणूच्या बाह्यतम कक्षेत 7 इलेक्ट्रॉन असतात. क्लोरीनचा एक अणू 1 इलेक्ट्रॉन स्वीकारून बाह्यतम कक्षेत अष्टक पुरे करून क्लोराइडचा ऋण आयन तयार होतो.
एका मेग्नेशिअमच्या अणूकडून दिलेले 2 इलेक्ट्रॉन क्लोरीनचे दोन अणू स्वोकारून दोन क्लोरीनचे ऋण आयन तयार होतात. मॅग्नेशिअमचा धन आयन व क्लोरीनचे ऋण आयन यांमधील विद्युत स्थितिक आकर्षणामुळे त्यांमध्ये आयनिक बंध तयार होऊन मॅग्नेशिअम
क्लोराइड तयार होते.
Mg → Mg++ + 2e− ;
(2, 8, 2) (2, 8)
2Cl + 2e− → 2Cl−
(2, 8, 7) (2, 8, 8)
Mg++ + 2Cl− → MgCl2
प्रश्न 5. खालील संयुगे पाण्यात विरघळल्यास त्यांचे विचरण कसे होते ते रासायनिक समीकरणाने दर्शवा व विचरणाचे प्रमाण कमी की जास्त ते लिहा.
हायड्रोक्लोरिक आम्ल, सोडिअम क्लोराइड, पोटॅशिअम हायड्रॉक्साइड, अमोनिआ, अॅसेटिक आम्ल, मॅग्नेशिअम क्लोराइड, कॉपर सल्फेट.
(i) हायड्रोक्लोरिक आम्ल
HCI ![]() H+ + Cl− विचरणाचे प्रमाण जास्त
H+ + Cl− विचरणाचे प्रमाण जास्त
(ii) सोडिअम क्लोराइड
NaCl ![]() Na+ + Cl− विचरणाचे प्रमाण जास्त
Na+ + Cl− विचरणाचे प्रमाण जास्त
(iii) पोटॅशिअम हायड्रॉक्साइड
KOH ![]() K+ +OH− विचरणाचे प्रमाण जास्त
K+ +OH− विचरणाचे प्रमाण जास्त
(iv) अमोनिआ
NH3 ![]() NH4+ + OH− विचरणाचे प्रमाण कमी
NH4+ + OH− विचरणाचे प्रमाण कमी
(v) अॅसेटिक आम्ल
CH3COOH ![]() H+ + CH3COO− विचरणाचे प्रमाण कमी
H+ + CH3COO− विचरणाचे प्रमाण कमी
(vi) मॅग्नेशिअम क्लोराइड
MgCl2 ![]() Mg2+ + 2Cl− विचरणाचे प्रमाण कमी
Mg2+ + 2Cl− विचरणाचे प्रमाण कमी
(vii) कॉपर सल्फेट
CuSO4 ![]() Cu2+ + SO42- विचरणाचे प्रमाण जास्त
Cu2+ + SO42- विचरणाचे प्रमाण जास्त
प्रश्न 6. पुढील द्रावणाची संहती ग्रॅम/लीटर व मोल/लीटर हया एककांमध्ये व्यक्त करा.
(अ) 100 मिली द्रावणात 7.3 ग्रॅम HCl
दिलेले: HCl चे वस्तुमान = 7.3 ग्रॅ., द्रावणाचे आकारमान = 100 मिली. = 0.1 लीटर
HCl चे रेणुवस्तुमान = 36.5 u
ग्रॅम/लीटर मधील संहती = ![]() = \(\frac{7.3}{0.1}\) = 73 ग्रॅम/लीटर
= \(\frac{7.3}{0.1}\) = 73 ग्रॅम/लीटर
मोल = ![]() = \(\frac{7.3}{36.5}\) = 0.2 मोल
= \(\frac{7.3}{36.5}\) = 0.2 मोल
मोल/लीटर मधील द्रावणाची रेणूता = ![]() = \(\frac{0.2}{0.1}\) = 2 मोल/लीटर
= \(\frac{0.2}{0.1}\) = 2 मोल/लीटर
दिलेल्या द्रावणाची संहती 73 ग्रॅम/लीटर आणि 2 मोल/लीटर आहे.
(आ) 50 मिली द्रावणात 2 ग्रॅम NaOH
NaOH चे वस्तुमान = 2 ग्रॅ., द्रावणाचे आकारमान = 50 मिली. = 0.05 लीटर
NaOH चे रेणुवस्तुमान = 40 u
ग्रॅम/लीटर मधील संहती = ![]() = \(\frac{2}{0.05}\) = 40 ग्रॅम/लीटर
= \(\frac{2}{0.05}\) = 40 ग्रॅम/लीटर
मोल = ![]() = \(\frac{2}{40}\) = 0.05 मोल
= \(\frac{2}{40}\) = 0.05 मोल
मोल/लीटर मधील द्रावणाची रेणूता = ![]() = \(\frac{0.05}{0.05}\) = 1 मोल/लीटर
= \(\frac{0.05}{0.05}\) = 1 मोल/लीटर
दिलेल्या द्रावणाची संहती 40 ग्रॅम/लीटर आणि 1 मोल/लीटर आहे.
(इ) 100 मिली द्रावणात 3 ग्रॅम CH3COOH
CH3COOH चे वस्तुमान = 3 ग्रॅ., द्रावणाचे आकारमान = 100 मिली. = 0.1 लीटर
CH3COOH चे रेणुवस्तुमान = 60 u
ग्रॅम/लीटर मधील संहती = ![]() = \(\frac{3}{0.1}\) = 30 ग्रॅम/लीटर
= \(\frac{3}{0.1}\) = 30 ग्रॅम/लीटर
मोल = ![]() = \(\frac{3}{60}\) = 0.05 मोल
= \(\frac{3}{60}\) = 0.05 मोल
मोल/लीटर मधील द्रावणाची रेणूता = ![]() = \(\frac{0.05}{0.1}\) = 0.5 मोल/लीटर
= \(\frac{0.05}{0.1}\) = 0.5 मोल/लीटर
दिलेल्या द्रावणाची संहती 30 ग्रॅम/लीटर आणि 0.5 मोल/लीटर आहे.
(ई) 200 मिली द्रावणात 4.9 ग्रॅम H2SO4
H2SO4 चे वस्तुमान = 4.9 ग्रॅ., द्रावणाचे आकारमान = 200 मिली. = 0.2 लीटर
H2SO4 चे रेणुवस्तुमान = 98 u
ग्रॅम/लीटर मधील संहती = ![]() = \(\frac{4.9}{0.2}\) = 24.5 ग्रॅम/लीटर
= \(\frac{4.9}{0.2}\) = 24.5 ग्रॅम/लीटर
मोल = ![]() = \(\frac{4.9}{98}\) = 0.05 मोल
= \(\frac{4.9}{98}\) = 0.05 मोल
मोल/लीटर मधील द्रावणाची रेणूता = ![]() = \(\frac{0.05}{0.2}\) = 0.25 मोल/लीटर
= \(\frac{0.05}{0.2}\) = 0.25 मोल/लीटर
दिलेल्या द्रावणाची संहती 24.5 ग्रॅम/लीटर आणि 0.25 मोल/लीटर आहे.
प्रश्न 7. खालील प्रश्नांची उत्तरे लिहा.
(अ) आम्लारिधर्मता ह्या गुणधर्मा नुसार आम्लांचे वर्गीकरण करा. प्रत्येकी एक उदाहरण लिहा.
आम्लाच्या एका रेणूच्या विचरणाने जितके H+ आयन मिळू शकतात ती संख्या म्हणजे आम्लाची आम्लारिधर्मता होय.
(1) एकआम्लारिधर्मता असणारे आम्ल (Monobasic acid) : HCl, HNO3, CH3COOH.
(2) द्विआम्लारिधर्मता असणारे आम्ल (Dibasic acid) : H2SO4, H2SO3.
(3) त्रिआम्लारिधर्मता असणारे आम्ल (Tribasic acid) : H3PO4, H3BO3.
(आ) उदासिनीकरण म्हणजे काय? दैनंदिन जीवनातील उदासिनीकरणाची दोन उदाहरणे लिहा.
आम्लाची आम्लारीशी अभिक्रिया केली असता, क्षार व पाणी तयार होते. या क्रियेला उदासिनीकरण म्हणतात.
आम्ल + आम्लारी → क्षार + पाणी
HCl(aq) + NaOH(aq) → NaCl + H2O
आम्लातून H+ आयन तयार होतात आणि आम्लारीतून OH− आयन तयार होतात.
H+(aq) + OH−(aq) → H20(l)
आम्लातील H+ आयन व अल्कलीतील OH− आयन यांची परस्परांशी अभिक्रिया होऊन आयनीभवन न झालेले पाणी तयार होते. यालाच उदासिनीकरण म्हणतात.
दैनंदिन जीवनातील उदाहरणे :
(1) जठरात तयार होणारे हायड्रोक्लोरिक आम्ल अन्नाचे पचन करण्यास मदत करते. मात्र हे आम्लाचे प्रमाण जास्त झाल्यास पोट दुखते, मळमळते, यामुळे अपचन होते. हे टाळण्यासाठी आम्ल-प्रतिबंधकाचा वापर करतात. आम्लप्रतिबंधकामुळे जठरात तयार झालेल्या अधिक आम्लाचे उदासिनीकरण होते.
(2) सकाळी दात घासण्यापूर्वी लाळेचे pH 7 पेक्षा कमी असते, म्हणजे आम्लधर्मी असते. म्हणून टूथपेस्ट ही आम्लारी असून दात स्वच्छ होऊन तोंडातल्या लाळेचे असलेल्या अधिक आम्लाचे उदासिनीकरण होते. यामुळे दातांची झीज थांबते.
(इ) द्रावणाचा सामू मोजण्यासाठी कोणत्या पद्धती वापरतात ते लिहा.
- द्रावणाचा सामू मोजण्यासाठी सामू मापनश्रेणी (pH scale) वापरली जाते.
- वैश्विक दर्शकाचे द्रावण किंवा त्यापासून बनवलेल्या कागदी दर्शकपट्टिकेचा उपयोग करून सामू ठरवता येतो.
- सामू मोजण्याची सर्वांत अचूक पद्धत म्हणजे सामूमापक (pH meter) हे विद्युत साधन वापरले जाते.
(ई) पाण्याचे विद्युत अपघटन म्हणजे काय ते सांगून विद्युतअग्र अभिक्रिया लिहून स्पष्ट करा.
आम्लयुक्त किंवा आम्लारीयुक्त पाण्यातून विद्युतधारा जाऊ दिली असता त्याचे पृथक्करण होऊन ऋणाग्रापाशी हायड्रोजन वायू तयार होतो व धनाग्रापाशी ऑक्सिजन वायू तयार होतो. यालाच पाण्याचे विद्युत अपघटन म्हणतात.
ऋणाग्र अभिक्रिया : 2H2O + 2e− → H2(g) + 2OH−(aq)
धनाग्र अभिक्रिया : 2H2O → O2(g) + 4H−(aq) + 4e−
प्रश्न 8. खालील कृतीसाठी रासायनिक समीकरणे लिहा.
(अ) HCl च्या द्रावणात NaOH चे द्रावण मिळवले.
HCl च्या द्रावणात NaOH मिळवले असता रासायनिक अभिक्रिया होऊन सोडिअम क्लोराइड व पाणी तयार होते. ही उदासिनीकरणाची अभिक्रिया आहे.
HCl(aq) + NaOH(aq) → NaCl(ag) + H2O(l)
(आ) विरल H2SO4 मध्ये जस्ताचे चूर्ण मिळवले.
विरल H2SO4 मध्ये जस्ताचे चूर्ण मिळवल्यास, जस्ताची विरल सल्फ्युरिक आम्लाबरोबर अभिक्रिया होऊन हायड्रोजन वायू मुक्त होतो व झिंक सल्फेट तयार होते.
Zn + H2SO4 → ZnSO4(aq) + H2(g)
(इ) कॅल्शिअम ऑक्साइड मध्ये विरल नायट्रिक अॅसिड मिळवले.
कॅल्शिअम ऑक्साइडमध्ये विरल नायट्रिक अॅसिड मिळवले असता, कॅल्शिअम नायट्रेट व पाणी तयार होते.
CaO + 2HNO3 → Ca(NO3)2(aq) + H2O
(ई) KOH च्या द्रावणामधून कार्बन डायऑक्साइड वायू सोडला.
KOH च्या द्रावणातून कार्बन डायऑक्साइड वायू सोडला असता, पोटॅशिअम कार्बोनेट व पाणी तयार होते.
CO2(g) + 2KOH(aq) → K2CO3(aq) + H2O
(उ) खाण्याच्या सोड्यावर विरल HCl ओतले.
खाण्याच्या सोड्यावर (NaHCO3) विरल HCI ओतले असता, सोडिअम क्लोराइड तयार होते व फसफसणारा CO2 वायू मुक्त होतो.
प्रश्न 9. फरक लिहा.
(अ) आम्ल व आम्लारी
| आम्ल | आम्लारी |
| आम्ले चवीला आंबट असतात. | आम्लारी चवीला तुरट असतात. |
| आम्लामध्ये निळा लिटमस कागद लाल होतो. | आम्लारीमध्ये लाल लिटमस निळा होतो. |
| आम्लात एक किंवा जास्त H+ आयन असतात. | आम्लारीत एक किंवा जास्त OH- हायड्रॉक्साइड आयन असतात. |
| अधातूंच्या ऑक्साइडपासून आम्ल तयार होते. | धातूंच्या ऑक्साइडपासून आम्लारी तयार होते. |
| आम्लांची आम्लारींशी अभिक्रिया होते व क्षार व पाणी तयार होते. | आम्लारींची आम्लांशी अभिक्रिया होते, क्षार व पाणी तयार होते. |
| उदा., HCl, H2SO4, H3PO4. | उदा., NaOH, KOH, Ca(OH)2. |
(आ) कॅटायन व ॲनायन
| कॅटायन | ॲनायन |
| धनप्रभारित आयनांना कॅटायन म्हणतात. | ऋणप्रभारित आयनांना अॅनायन म्हणतात. |
| विद्युतधारेच्या प्रभावामुळे कॅटायन ऋणाग्राकडे आकर्षिले जातात. | विद्युतधारेच्या प्रभावामुळे अॅनायन धनाग्राकडे आकर्षिले जातात. |
| सामान्यतः धातूंचे व हायड्रोजनचे आयन हे कॅटायन असतात. | सामान्यतः अधातूंचे आयन हे अॅनायन असतात. |
| उदा.,Na+, H+, Mg2+. | उदा., Cl-, Br-, OH-, |
(इ) ऋणाग्र व धनाग्र
| ऋणाग्र | धनाग्र |
| ऋणप्रभारित इलेक्ट्रोडला ऋणाग्र म्हणतात. | धनप्रभारित इलेक्ट्रोडला धनाग्र म्हणतात. |
| कॅटायन ऋणाग्राकडे आकर्षिले जातात. | अॅनायन धनाग्राकडे आकर्षिले जातात. |
| ऋणाग्रापाशी इलेक्ट्रॉन दिले जातात. | धनाग्रापाशी इलेक्ट्रॉन स्वीकारले जातात. |
प्रश्न 10. खालील पदार्थांच्या जलीय द्रावणाचे वर्गीकरण सामूप्रमाणे 7, 7 पेक्षा जास्त व 7 पेक्षा कमी या गटांत करा.
मीठ, सोडिअम अॅसिटेट, हायड्रोजन क्लोराइड, कार्बन डायऑक्साइड, पोटॅशिअम ब्रोमाइड, कॅल्शिअम हायड्रॉक्साइड, अमोनिअम क्लोराइड, व्हिनेगार, सोडिअम कार्बोनेट, अमोनिआ, सल्फर डायऑक्साइड.
- सामू 7 : मीठ,
- सामू 7 पेक्षा जास्त : सोडिअम अॅसिटेट, पोटॅशिअम ब्रोमाइड, कॅल्शिअम हायड्रॉक्साइड, सोडिअम कार्बोनेट, अमोनिआ.
- सामू 7 पेक्षा कमी : हायड्रोजन क्लोराइड, कार्बन डायऑक्साइड, अमोनिअम क्लोराइड, व्हिनेगार, सल्फर डायऑक्साइड.
Click on link to get PDF from store :
PDF : Marathi Medium-Class 9-विज्ञान आणि तंत्रज्ञान-पाठ-5- आम्ल, आम्लारी व क्षार-Notes
PDF : Marathi Medium-Class 9-विज्ञान आणि तंत्रज्ञान-पाठ-5- आम्ल, आम्लारी व क्षार-Solutions
PDF : Marathi Medium-Class 9-विज्ञान आणि तंत्रज्ञान-पाठ-5- आम्ल, आम्लारी व क्षार-Text Book
PDF : महाराष्ट्र बोर्ड- कक्षा- 9 विज्ञान व तंत्रज्ञान-मराठी माध्यम सर्व 18 धड्यांची नोट्स (18 PDF) Rs. 72
Useful links :
| Main Page : - Marathi Medium-Class 9-विज्ञान आणि तंत्रज्ञान- All chapters notes, solutions, videos, test, pdf.
Previous Chapter : पाठ-4- द्रव्याचे मोजमाप - online Solutions Next Chapter : पाठ-6- वनस्पतींचे वर्गीकरण- online Solutions |
