मूलद्रव्यां चे आवर्ती वर्गीकरण.
Based on Class 10 -विज्ञान आणि तंत्रज्ञान-भाग-1-पाठ-2- Maharashtra Board
Notes
|
अभ्यासघटक :
|
मूलद्रव्य व मूलद्रव्यांचे वर्गीकरण :
द्रव्याचे प्रकार : स्थायू, द्रव, वायू आणि प्लाझ्मा. (प्लाझ्मा ही उच्च तापमानात आढळते.)
मूलद्रव्यांचे प्रकार : धातू, अधातू आणि धातुसदृश.
अणू : द्रव्याच्या लहानात लहान कणांना अणू म्हणतात.
मूलद्रव्ये ब संयुगे यांच्या रेणूंमधील फरक :
| मूलद्रव्ये | संयुगे |
| (1) मूलद्रव्यात प्रत्येक कण एकसारख्याच पदार्थाने बनलेला असतो.
(2) कोणत्याही भौतिक किंवा रासायनिक पद्धतीने मूलद्रव्यांच्या कणांचे विभाजन करता येत नाही. उदा., तांबे, लोखंड, ऑक्सिजन |
(1) संयुग हे दोन किंवा अधिक विविध मूलद्रव्यांपासून बनलेले असते.
(2) संयुगांच्या रेणूंचे रासायनिक प्रक्रियेने अपघटन करता येते. उदा., मीठ, पाणी, साखर.
|
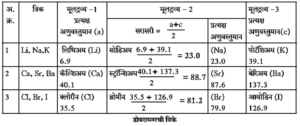
डोबरायनरची त्रिके :
डोबरायनरची त्रिके (Dobereiner’s Triads) : सन 1817 मध्ये डोबरायनर (जर्मन वैज्ञानिक) याने मूलद्रव्यांचे गुणधर्म व त्यांची अणुवस्तुमाने यात संबंध असल्याचे सिद्ध केले.
- त्याने एकसारखे रासायनिक गुणधर्म असणाऱ्या प्रत्येकी तीन मूलद्रव्यांचे गट तयार केले व त्या गटांना त्रिके असे संबोधले.
- एका त्रिकामधील तीन मूलद्रव्यांची मांडणी त्याने अणुवस्तुमानाच्या चढत्या क्रमाने केली व दाखवले की, मधल्या मूलद्रव्याचे अणुवस्तुमान हे साधारणत: इतर दोन अन्य मूलद्रव्यांच्या अणुवस्तुमानांच्या सरासरीइतके असते.
न्यूलॅंड्सच्या अष्टकांचा नियम :
न्यूलॅंड्सच्या अष्टकांचा नियम (Newlands’ Law of Octaves) : सन 1866 मध्ये न्यूलँड्सने त्या काळी माहीत असलेली मूलद्रव्ये त्यांच्या अणुवस्तुमानांच्या चढत्या क्रमाने मांडणी केली असता, त्याला असे दिसले की प्रत्येक आठव्या मूलद्रव्याला पहिल्या मूलद्रव्यासारखे गुणधर्म होते. जसे सोडिअम हे लीथिअमपासून आठवे मूलद्रव्य असून दोघांचे गुणधर्म एकसारखे आहित.
न्यूलॅंड्स अष्टकांच्या नियमातील त्रुटी (Limitations of Newlands’ Octaves) :
- न्यूलॅंड्सला ज्ञात असलेल्या 56 मूलद्रव्यांपैकी कॅल्शिअम पर्यंतच्या मूलद्रव्यांची त्यांच्या अणुवस्तुमानाच्या चढत्या क्रमानुसार मांडणी केली
- या मांडणीची सुरुवात सर्वांत हलक्या हायड्रोजन या मूलद्रव्याने तर शेवट थोरिअमने झाला.
- न्यूलँड्सने काही जागांवर दोन-दोन मूलद्रव्ये बसविली. उदा. Co व Ni , Ce व La. याशिवाय त्याने काही भि न्न गुणधर्मां ची मूलद्रव्ये अष्टकातील एकाच स्वराखाली ठेवली. उदा. Co व Ni या धातूंना न्यूलँडसने ‘डो’ या स्वराखाली Cl व Br या हॅलोजनांबरोबर ठेवले. या उलट Co व Ni यांच्याशी साधर्म्य असणाऱ्या Fe ला त्यांच्यापासून लांब O व S या अधातूंबरोबर ‘टी’ या स्वराखाली ठेवले.
- तसेच नव्याने शोध लागलेल्या मूलद्रव्यांना सामावून घेण्याची तरतूद न्यूलँड्सच्या अष्टकात नव्हती.
- नव्याने शोध लागलेल्या मूलद्रव्यांचे गुणधर्म न्यूलॅडूसच्या अष्टकांच्या नियमात बसले नाहीत.
मेंडेलीव्हची आवर्तसारणी :
मेंडेलीव्हची आवर्तसारणी (Mendeleev’s Periodic table) :
- अणुवस्तुमान हा मूलद्रव्यांचा मूलभूत गुणधर्म प्रमाण मानून मेंडेलीव्हने त्याकाळी ज्ञात असलेली 63 मूलद्रव्ये त्यांच्या अणुवस्तुमानांच्या चढत्या क्रमाने मांडली.
- या मूलद्रव्यांच्या भौतिक व रासायनिक गुणधर्मानुसार मेंडेलीव्हने मूलद्रव्यांच्या आवर्तसारणीची रचना केली.
- हे गुणधर्म विचारात घेता मेंडेलीव्हला असे आढळून आले की, मूलद्रव्यांच्या भौतिक आणि रासायनिक गुणधर्मांची काही ठरावीक अवधीनंतर पुनरावृत्ती होते.
मंडेलीव्हचा आवर्ती नियम : मूलद्रव्यांचे भौतिक आणि रासायनिक गुणधर्म हे त्यांच्या अणुवस्तुमानाचे आवर्तीफल आहे. मेंडेलीव्हच्या आवर्तसारणीमधील उभ्या स्तंभांना गण म्हणतात, तर आडव्या ओळींना आवर्त म्हणतात.
मेंडेलीव्हच्या आवर्तसारणीचे गुण (Merits of Mendeleev’s periodic table) :
- आवर्तसारणीत गुणधर्मांप्रमाणे योग्य स्थान देता यावे म्हणून काही मूलद्रव्यांचे अणुवस्तुमान पुन्हा तपासून दुरुस्त करण्यात आले. उदा., बेरिलिअमचे यापूर्वीचे 14.09 हे अणुवस्तुमान बदलून 9.4 असे दुरुस्त करण्यात आले. बेरिलिअमला बोरॉनच्या आधीची जागा दिली.
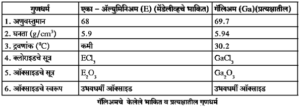
- आवर्तसारणीमध्ये मेंडेलीव्हने शोध न लागलेल्या मूलद्रव्यांसाठी काही जागा रिक्त ठेवल्या. त्यांपैकी तीन अज्ञात मूलद्रव्यांना जवळच्या ज्ञात मूलट्रव्यांवरून एका -बोरॉन, एका – अल्युमिनिअम व एका-सिलिकॉन अशी नावे दिली व मेंडेलीव्हने त्यांची अणुवस्तुमाने अनुक्रमे 44, 68 व 72 असतील असे दर्शवले. त्याप्रमाणे त्यांच्या गुणधर्मांचेही भाकीत कले. पुढे या मूलद्रव्यांचा शोध लागून त्यांना अनुक्रमे स्कँडिअम (Sc), गॅलिअम (Ga) व जर्मेनिअम (Ge) अशी नावे देण्यात आली. या मूलद्रव्यांचे गुणधर्म मेंडेलीव्हच्या भाकीताशी जुळणारे आढळले. यामुळे मेंडेलीव्हच्या आवर्तसारणीचे महत्त्व पटले.
- जेव्हा हेलिअम, निऑन, अरगॉन इत्यादी निष्क्रिय बायूंचा शोध लागला तेव्हा मेंडेलीव्हने मूळ आवर्तसारणीला धक्का न लावता शून्यगण निर्माण केला ब त्यात निष्क्रिय वायू (राजवाय् ) ठेवण्यात आले.
| मेंडेलीव्ह यांनी 1868 मध्ये ' प्रिन्सिपल्स ऑफ केमिस्ट्री ' हे महत्त्वाचे पुस्तक लिहिले. त्यांनी मूलद्रव्यांच्या अभ्यासाच्या हेतूने प्रत्येक ज्ञात मूलद्रव्यासाठी एकेक कार्ड बनवून त्यावर मूलद्रव्यांचे अणुवस्तुमान दर्शवून अणुवस्तुमान व गुणधर्म यांच्या आधारे कार्डाची जी जुळणी केली त्यातून मूलद्रव्यांच्या आवर्तसारणीचा शोध लागला. |
मेंडेलीव्हच्या आवर्तसारणीतील त्रुटी (Demerits of Mendeleev’s periodic table) :
- मेंडेलीव्हच्या आवर्तसारणीत कोबाल्ट (Co) ब निकेल (Ni) या मूलद्रव्यांचे पूर्णांकी अणुवस्तुमान समान असल्याने त्यांच्या क्रमाबद्दल संदिग्धता होती.
- मेंडेलीव्हने आवर्तसारणी मांडल्यानंतत खूप काळाने समस्थानिकांचा शोध लागला. समस्थानिकांचे रासायनिक गुणधर्म समान, तर भिन्न अणुवस्तुमाने असल्यामुळे मेंडेलीव्हच्या आवर्तसारणीत त्यांना स्थान कशा प्रकारे द्यावयाचे हे एक मोठे आव्हान होते.
- मूलद्रव्यांच्या वाढत्या अणुवस्तुमानाप्रमाणे मांडलेल्या अणुवस्तुमानांमधील बाढ नियमित दराने होताना दिसत नाही. त्यामुळे दोन जड मूलद्रव्यांमध्ये किती मूलद्रव्यांचा शोध लागेल याचे भाकीत करणे मेंडेलीव्हच्या आवर्ती नियमानुसार शक्य नव्हते.
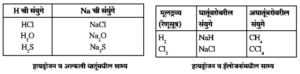
- हायड्रोजनचे स्थान : हायड्रोजन हा हॅलोजनांशी (गण VII) साम्य दर्शवतो, हायड़रोजनची जागा अल्क धातूंच्या गणात (गण I) की हॅलोजनांच्या गणात (गण VII) हे निश्चित देता आले नाही.
आधुनिक आवर्तसारणी :
मेंडेलीव्हने आवर्त सारणी मांडली तेव्हा विज्ञानजगताला अणूच्या अंत रंगाविषयी माहिती नव्हती. मेंडेलीव्हच्या आवर्त सारणीत अणुअंक हा केवळ मूलद्रव्यांचा क्रमदर्शक अंक होता.
वैज्ञानिक हेनरी मोजले (Henry Moseley) याने केलेल्या प्रयोगांनी दाखवून दि ले की मूलद्रव्याचा अणुअंक (Z) म्हणजेच त्या मूलद्रव्याच्या अणुकेंद्रकावरील धनप्रभार अथवा त्याची प्रोटॉन संख्या होय. मोजलेने अनेक मूलद्रव्यांचे अणुअंक प्रयोगांनी निश्चित केले. त्यामुळे अणुवस्तुमानापेक्षा मूलद्रव्यांचा अधि क मूलभूत गुणधर्म ‘अणुअंक’ हा आहे हे लक्षात आले.
आधुनिक आवर्ती नियम (Modern Periodic Law) :
मोजलेने मेंडेलीव्हच्या आवर्ती नियमात बदल करून आधुनिक आवर्ती नियम मांडला तो याप्रमाणे : मूलद्रव्यांचे भोतिक आणि रासायनिक गुणधर्म हे त्यांच्या अणुअंकांचे आवर्तीफल आहित.
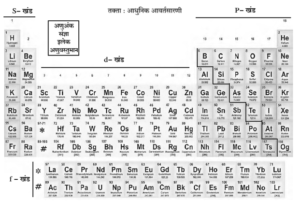
आधुनिक आवर्तसारणीची रचना (Structure of the Modern Periodic Table) :
- आधुनिक आवर्तसारणीमध्ये मूलद्रव्ये त्यांच्या अणुअंकांच्या चढत्या क्रमाने मांडलेली आहेत.
- आधुनिक आवर्तसारणीमध्ये 1 ते 7 आडव्या ओळी आहेत, त्यांना आवर्त म्हणतात. तसेच या सारणीतील (1 ते 18) अठरा उभे स्तंभ आहेत, त्यांना गण म्हणतात. आवर्त ब गण यांच्या रचनेतून चौकटी तयार होतात.
- प्रत्येक चौकट ही एका मूलद्रव्याची जागा आहे. आवर्तसारणीच्या तळाशी सात ओळींव्यतिरिक््त आणखी दोन ओळी स्वतंत्रपणे दाखवलेल्या आहेत. त्यांना अनुक्रमे लॅन्थॅनाइड श्रेणी आणि ऑक्टिनाइड श्रेणी असे म्हणतात. दोन श्रेणींसहित आवर्तसारणीमध्ये 118 चौकटी आहेत. म्हणजेच 118 मूलद्रव्यांसाठी जागा आहेत.
- अगदी नजीकच्या काळात काही मूलद्रव्यांची निर्मिती प्रयोगसिद्ध झाल्यामुळे आता ही आवर्तसारणी सर्व 118 मूलद्रव्यांनी पूर्ण भरली आहे.
- संपूर्ण आवर्तसारणी मूलद्रव्यांच्या इलेक्ट्रॉनी संरूपणाच्या आधारे एस-खंड, पी-खंड, डी-खंड व एफ-खंड अशा चार खंडांमध्ये विभागली आहे.
- एस-खंडात 1 व 2 हे गण येतात. गण 13 ते गण 18 हे पी-खंडामध्ये येतात. गण 3 ते गण 12 हे डी-खंडात येतात; तर तळाच्या लॅन्थॅनाइड आणि ऑँक्टिनाइड श्रेणी एफ-खंडात येतात. डी-खंडातील मूलद्रव्यांना संक्रमक मूलद्रव्ये म्हणतात.
- आवर्तसारणीच्या पी-खंडामध्ये एक नागमोडी रेषा दिसून येते. या नागमोडी रेषेच्या साहाय्याने मूलद्रव्यांचे पारंपरिक तीन प्रकार आधुनिक आवर्तसारणीमध्ये स्पष्टपणे दाखवता येतात.
- नागमोडी रेषेच्या आजूबाजूला धातुसदृश मूलद्रव्ये आहेत. नागमोडी रेषेच्या डाव्या बाजूला सर्व धातू असून उजव्या बाजूला सर्व अधातू आहेत.
आधुनिक आवर्तसारणी व मूलद्रव्यांचे इलेक्ट्रॉन संरूपण (Modern Periodic Table and electronic configuration of the elements) :
- आधुनिक आवर्तसारणीतील गण व आवर्तांची ही वैशिष्ट्ये मूलद्रव्यांच्या इलेक्ट्रॉन संरूपणांमुळे आहेत.
- एखादे मूलद्रव्य आधुनिक आवर्तसारणीच्या कोणत्या गणात ब आवर्तामध्ये ठेवायचे हे त्याच्या इलेक्ट्रॉन संरूपणावरून ठरते.
- एका आवर्तामध्ये बाजू-बाजूला असणाऱ्या मूलद्रव्यांच्या गुणधर्मांमध्ये कमी प्रमाणात फरक असतो, मात्र दूर असणाऱ्या मूलद्रव्यांच्या गुणधर्मांमध्ये खूपच फरक असतो.
- एका गणातील मूलद्रव्यांच्या रासायनिक गुणधर्मांमध्ये साधर्म्य ब प्रवणता (gradation) दिसून येते.
गण व इलेक्ट्रॉन स॑रूपण (Groups and electronic configuration) :
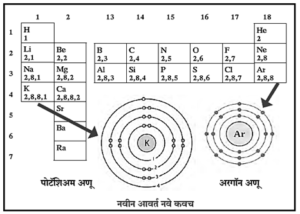
- गण 1 म्हणजेच अल्क धातूंच्या कुलामधील या सर्व मूलद्रव्यांच्या संयुजा - इलेक्ट्रॉन्सची संख्या समान आहे. तसेच, दुसऱ्या कोणत्याही एका गणातील मुलद्रव्ये पाहिली तर त्यांच्या संयुजा -- इलेक्ट्रॉनांची संख्या एकसमान असल्याचे दिसते.
- उदा., बेरिलिअम (Be), मॅग्नेशिअम (Mg) व कॅल्शिअम (Ca) ही मूलद्रव्ये गण 2 मध्ये म्हणजेच अल्कधमी मृदा धातूंचे कुल. त्यांच्या बाह्यतम कवचात दोन इलेक्ट्रॉन आहेत. त्यांची संयुजा इलेक्ट्रॉन संख्या 2 आहे. तसेच गण 17 मधील फ्लुओरीन (F) ब क्लोरीन (Cl) यांच्या बाह्यतम कवचात सात इलेक्ट्रॉन आहेत. त्यांची संयुजा इलेक्ट्रॉन संख्या 1 आहे.
- कोणत्याही एका गणात वरून खाली जाताना इलेक्ट्रॉनचे एकेक कवच वाढत जाते. यावरून असे. दिसून येते की, बाह्यतम कवचाचे इलेक्ट्रॉन संरूपण हे आधुनिक आवर्तसारणीतील त्या त्या गणांचे वैशिष्ट्य आहे.
आधुनिक आवर्तसारणीत :
- मूलद्रव्ये त्यांच्या चढत्या अणुक्रमांकाप्रमाणे मांडली आहेत.
- उभ्या स्तंभांना गण म्हणतात. एकूण गण 18 आहेत. एका गणातील मूलद्रव्यांच्या रासायनिक गुणधर्मांमध्ये साधर्म्य व प्रवणता असते.
गण व आवर्तांची बेशिष्ट्ये : एखाद्या विशिष्ट गणातील सर्व मूलद्रव्यांच्या विविध गुणधर्मांमध्ये साधर्म्य व प्रवणता असते. मात्र एखाद्या बिशिष्ट आवर्तामध्ये एका टोकाकडून दुसऱ्या टोकाकडे ( उदा., डावीकडून उजवीकडे) जाताना मूलद्रव्यांचे गुणधर्म क्रमाक्रमाने थोडे थोडे बदलत जातात.
आवर्त आणि इलेक्ट्रॉन संरुपण (Periods and electronic configuration) :
- आधुनिक आवर्तसारणीत सात आडव्या ओळी आहेत; त्यांना आवर्त म्हणतात.
- आवर्तातील मूलट्रव्यांमधील संयुजेतील होणारा बदल इलेक्ट्रॉन संरूपणाप्रमाणे होत असतो.
- मूलद्रव्यांमधील संयुजा -इलेक्ट्रॉनांची संख्या वेगवेगळी असते. मात्र त्यांच्यातील कवचांची संख्या एकसारखी दिसते. आवर्तामध्ये डावीकडून उजवीकडे जाताना जसा अणुअंक एकाने वाढतो तशी संयुजा -इलेक्ट्रॉनांची संख्यासुद्धा एकने वाढते.
- ज्या मूलद्रव्यांमधील इलेक्ट्रॉन असलेल्या कवचांची संख्या एकसारखी असते तेव्हा ती मूलद्रव्ये एकाच आवर्तात असतात. K व L, दुसऱ्या आवर्तातील Li, Be, B, C, N, O, F व Ne या मूलद्रव्यांचे,
- इलेक्ट्रॉन असतात. K, L, व M या तीन कवचांमध्ये तिसऱ्या आवर्तात असलेल्या Na, Mg, Al, Si, P, S, Cl व Ar या मूलद्रव्यांचे इलेक्ट्रॉन असतात.
- मूलदव्याची रासायनिक अभिक्रियाशीलता ही त्याच्या संयुजा-इलेक्ट्रॉनांची संख्या व संयुजा-कवच कोणते आहे यावरून ठरते. आवतांमध्ये डाबीकडून उजवीकडे जाताना अणुअंक एक-एकाने वाढत जातो, तर अणुत्रिज्या कमी कमी होत जाते व त्यामुळे आकारमान कमी होते. त्यामुळे संयुजा इलेक्ट्रॉन गमावण्याची अणूची प्रवृत्ती कमी कमी होत जाते. म्हणजेच आवर्तामध्ये डावीकडून उजबीकडे जाताना मूलद्रव्यांचा धातु-गुणधर्म कमी कमी होत जातो व अधातु-गुणधर्म वाढत जातो.
आधुनिक आवर्तसारणीतील कल (Periodic trends in the modern periodic table) :
आधुनिक आवर्तसारणीच्या एखाद्या आवर्तातील किंवा एखाद्या गणातील मूलद्रव्यांच्या गुणधर्मांची तुलना केली असता, त्यांच्यात होणाऱ्या बदलांमध्ये काही नियमितता दिसून येते. यालाच आधुनिक आवर्तसारणीतील कल म्हणतात. उदा., संयुजा, अणु-आकारमान व धातू-अधातू गुणधर्म हे आधुनिक आवर्तसारणीतील कल दर्शवतात.
संयुजा : मूलद्रव्याच्या अणूच्या बाह्यतम कवचात असणारे इलेक्ट्रॉन्स म्हणजेच संयुजा इलेक्ट्रॉन्स. या संयुजा इलेक्ट्रॉन्सच्या संख्येवरून मूलद्रव्याची संयुजा ठरते.
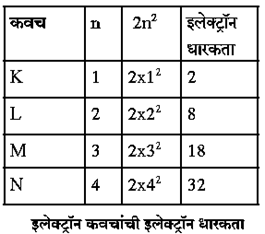
प्रश्न : इलेक्ट्रॉन कवचात जास्तीत जास्त किती इलेक्ट्रॉन सामावता येतात? सूत्र लिहा.
उत्तर : इलेक्ट्रॉन कवचात जास्तीत जास्त 32 इलेक्ट्रॉन सामावता येतात व त्यांचे सूत्र 2n2 आहे.
अणु-आकारमान (Atomic size) : अणूचा आकार हा त्याच्या त्रिज्येवरून ठरवला जातो. अणूमध्ये अणूची त्रिज्या म्हणजे अणूचे केंद्र व बाह्यतम कक्षा यांतील अंतर होय. ही त्रिज्या पिकोमीटर (pm) मध्ये मोजली जाते. (1 pm – 10-12m).
अणूचा आकार हा त्याच्यामध्ये असणाऱ्या इलेक्ट्रॉन कवचांच्या संख्येवर अवलंबून असतो. कवचांची संख्या जितकी जास्त तितका आकार मोठा. गणामध्ये खाली जाताना अणूचे आकारमान वाढत जाते, कारण गणात खाली जाताना नवीन कवचाची भर पडत जाते. त्यामुळे बाह्यतम इलेक्ट्रॉन व अणुकेंद्रक यांच्यातील अंतर वाढत जाते. याचा परिणाम म्हणजे केंद्रकीय प्रभार बाढूनसुद्धा अणूचे आकारमान वाढत जाते.
आवर्तामध्ये डावीकडून उजबीकडे जाताना अणूत्रिज्या कमी कमी होत जाते. कारण एका आवर्तामध्ये डावीकडून उजवीकडे जाताना अणअंक एक-एकाने वाढत जातो. म्हणजेच केंद्रावरील धनप्रभार एकेक एककाने वाढत जातो. मात्र त्याप्रमाणे भर पडलेला इलॅक्ट्रॉन हा असलेल्या बाह्यतम कवचामध्ये जमा होतो. वाढीव केंद्रकीय धनप्रभारामुळे इलेक्ट्रॉन केंद्रकाकडे अधिक प्रमाणात ओढले जातात व त्यामुळे अणूचे आकारमान कमी होते.
खाली काही मूलद्रव्ये व त्यांच्या अणुत्रिज्या दिल्या आहेत
| मूलद्रव्यः | O | B | C | N | B | Li | K | Na | Rb | Cs | Li |
| अणुत्रिज्या (pm) | 66 | 88 | 77 | 74 | 111 | 152 | 231 | 186 | 244 | 262 | 151 |
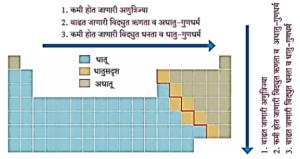
धातू-अधातू गुणधर्म : (Metallic-Nonmetallic character) : सोडिअम, मॅग्नेशिअम अशी धातुरूप मूलद्रव्ये डाव्या बाजूला आहेत. सल्फर, क्लोरीन अशी अधातुरूप मूलद्रव्ये उजव्या बाजूला आहेत. या दोन्ही प्रकारांमध्ये सिलिकॉन हे धातुसदूश मूलद्रव्य आहे.
आवर्तसारणीमध्ये एक नागमोडी रेषा धातूंना अधातूंपासून वेगळे करते असे दिसते. या रेषेच्या डाव्या बाजूला धातू, उजव्या बाजूला अधातू व रेषेवर / रेषेच्या आजूबाजूला रेषेच्या किनारीने धातुसदूश या प्रकारे मूलद्रव्यांची मांडणी झालेली दिसते.
| कोणत्याही गणात वरून खाली जाताना मूलद्रव्यांची विद्युत धनता वाढत जाते, तर विद्युत ऋणता कमी होत जाते.
कोणत्याही आवर्तात डावीकडून उजवीकडे जाताना मूलट्रव्यांची विद्युत ऋणता वाढत जाते व विद्युत धनता कमी होत जाते. मूलद्रव्याची विद्युत धनता किंबा विद्युत ऋणता जेवढी जास्त तेवढी त्याची अभिक्रियाशीलता जास्त. |
आधुनिक आवर्तसारणीतील धातु-गुणधर्माचा कल :
- धातूंमध्ये संयुजा -इलेक्ट्रॉन गमावून राजवायू संरूपण असलेला धनायन बनण्याची प्रवृत्ती असते. मूलद्रव्यांची ही प्रवृत्ती अथवा विद्युत धनता म्हणजेच त्या मूलद्रव्याचा धातु-गुणधर्म होय.
- अधातूमध्ये विद्युत ऋणतेमुळे बाहेरून इलेक्ट्रॉन स्वीकारून पूर्ण अष्टक स्थितीमधील ऋणायन बनण्याची प्रवृत्ती असते. मूलद्रव्याची ही प्रवृत्ती अथवा विद्युत ऋणता म्हणजे मूलद्रव्याचा अधातु-गुणधर्म होय.
- कोणत्याही गणात वरून खाली जाताना नव्या कवचाची भर पडून केंद्रक व संयुजा -इलेक्ट्रॉन यांच्यातील अंतर वाढत जाते. त्यामुळे परिणामी केंद्रकीय प्रभार कमी होऊन संयुजा-इलेक्ट्रॉनांवरील आकर्षण बल कमी होते. यामुळे संयुजा-इलेक्ट्रॉन गमावण्याची अणूची प्रवृत्ती वाढते. तसेच संयुजा-इलेक्ट्रॉन गमावल्यावर उपांत्य कवच बाह्यतम ठरते. हे उपांत्य कवच पूर्ण अष्टक असल्यामुळे तयार झालेल्या धनायनाला विशेष स्थैर्य प्राप्त होते. संयुजा -इलेक्ट्रॉन गमावण्याची अणूची प्रवृत्ती म्हणजेच धातु-गुणधर्म. कोणत्याही गणात वरून खाली जाताना विद्युत धनता बाढत जाते व मूलद्रव्याचा धातु-गुणधर्म वाढत जातो.
- एका आवर्तात डावीकडून उजवीकडे जाताना बाह्यतम कवच तेच राहते. मात्र केंद्रकावरील धनप्रभार वाढत गेल्याने, अणुत्रिज्या कमी होते व यामुळे प्रयुक्त होणारा परिणामी केंद्रकीय प्रभारसुद्धा वाढत जातो. त्यामुळे संयुजा -इलेक्ट्रॉन गमावण्याची प्रवृत्ती कमी कमी होत जाते. म्हणजेच आवर्तामध्ये डावीकडून उजवीकडे जाताना विद्युत ऋणता वाढत जाते व मूलद्रव्यांचा धातु-गुणधर्म कमी कमी होत जातो.
- एका आवर्तात डाबीकडून उजवीकडे जाताना वाढत जाणाऱ्या विद्युत ऋणतेमुळे बाहेरून इलेक्ट्रॉन स्वीकारून पूर्ण अष्टक स्थितीमधील कणायन बनण्याची अणूची क्षमता वाढते. ही प्रवृत्ती म्हणजेच अधातु-गुणधर्म. कोणत्याही आवर्तात डावीकडून उजवीकडे जाताना विद्युत क्रणता वाढत जाते. अधातु-गुणधर्म वाढत जातो.
मूलद्रव्यांमधील आवर्ती कल :
हॅलोजन कुलातील प्रवणता (Gradation in Halogen Family) :
गण 17 मध्ये हॅलोजन कुलाचे फ्ल्युओगीन, क्लोरीन, ब्रोमीन व आयोडीन हे सदस्य आहेत. सर्वांचे सर्वसाधारण रेणुसुत्र (X2) असे आहे. गणात वरून खाली जाताना त्यांच्या भौतिक स्थितीत प्रवणता दिसून येते. फ्ल्युओरीन (F2) व क्लोरीन (Cl2) हे वायू आहेत, ब्रोमीन (Br2) हा द्रव आहे, तर आयोडीन (I2)
हा स्थायू आहे.
- फ्ल्युओरीनचे इलेक्ट्रॉन संरूपण (2,7) आहे. फ्ल्युओरीनला बाह्यतम कक्षेत स्थिर अष्टक पुरे करण्यासाठी फक्त एका इलेक्ट्रॉनची आवश्यकता असते.
- सर्व हॅलोजनमध्ये फ्ल्युओरीनच्या अणूचा आकार सर्वांत लहान आहे; म्हणून त्याच्या अणूतील बाह्यतम कक्षेतील इलेक्ट्रॉनवा केंद्रकीय आकर्षण सर्वांत जास्त असते. म्हणून हॅलोजनमध्ये फ्ल्युओरीन हे सर्वांत क्रियाशील मूलद्रव्य आहे.
अल्कधर्मी मृदा धातूंची पाण्याबरोबरील अभिक्रिया :
अल्कधर्मी मृदा धातूंची पाण्याबरोबरील अभिक्रिया दर्शवणारे सर्वसाधारण रासायनिक समीकरण :
M + 2H2O à M (OH)2 + H2 आहे.
दुसऱ्या गणात वरून खाली Be à Mg à Ca à Sr à Ba असे जाताना या अल्कधर्मी मृदा धातूंची साधर्म्यातील प्रवणता आढळते.
वरून खाली जाताना अल्कधी मृदा धातूंची अभिक्रियाशीलता वाढत जाते व त्यामुळे ही अभिक्रिया घडण्यातील सहजतासुद्धा वाढत जाते. बेरिलिअमची (Be) पाण्याबरोबर अभिक्रिया होत नाही. मॅग्नेशिअमची अभिक्रिया पाण्याच्या वाफेबरोबर होऊ शकते; तर कॅल्शिअम (Ca), स्ट्रॉन्शिअम (Sr) व बेरिअम (Ba) यांच्या पाण्याबरोबरील अभिक्रिया कक्ष तापमानालाच अधिकाधिक दराने होताना दिसते.
Click on below link to get PDF from store
Marathi Medium-Class 10-विज्ञान आणि तंत्रज्ञान-भाग-१-पाठ-2-मूलद्रव्यांचे आवर्ती वर्गीकरण-Notes
Marathi Medium-Class 10-विज्ञान आणि तंत्रज्ञान-भाग-१-पाठ-2-मूलद्रव्यांचे आवर्ती वर्गीकरण-Solutions
Marathi Medium-Class 10-विज्ञान आणि तंत्रज्ञान-भाग-१-पाठ-2-मूलद्रव्यांचे आवर्ती वर्गीकरण-Text Books
Useful links :
| Main Page : - Maharashtra Board Class 10-Marathi Medium - विज्ञान आणि तंत्रज्ञान-भाग-१ - All chapters notes, solutions, videos, test, pdf.
Next Chapter : विज्ञान आणि तंत्रज्ञान-भाग-१ -पाठ - 2- मूलद्रव्यां चे आवर्ती वर्गीकरण. - Online Notes |