कार्बन : एक महत्त्वाचे मूलद्रव्य
Marathi Medium-Class 9-विज्ञान आणि तंत्रज्ञान-पाठ-13-Maharashtra Board
Notes
|
अभ्यासघटक :
|
मूलद्रव्य : ज्या पदार्थाचे भौतिक किंवा रासायनिक प्रक्रियेने अपघटन करता येत नाही, अशा पदार्थाला मूलद्रव्य म्हणतात.
- मूलद्रव्यांचे प्रकार : धातू, अधातू व धातुसदृश.
संयुग : दोन किंवा अधिक मूलद्रव्यांमध्ये रासायनिक अभिक्रिया घडून आल्यावर तयार होणाऱ्या पदार्थाला संयुग म्हणतात.
- वनस्पती व प्राणी यांच्यापासून प्रत्यक्ष किंवा अप्रत्यक्षपणे संयुगे तयार होतात. तसेच खनिजांपासून संयुगे तयार होतात.
कार्बन (Carbon) :
- कार्बन हे अधातू मूलद्रव्य आहे.
- कार्बनची संज्ञा C, अणुअंक 6 व इलेक्ट्रॉन संरूपण 2, 4 आहे. कार्बनची संयुजा 4 आहे.
कार्बनचा आढळ (Occurrence of Carbon ) :
- सर्व वनस्पती व प्राणिजन्य पदार्थांत कार्बन हा प्रमुख घटक असतो.
- कार्बन हे मूलद्रव्य निसर्गात मुबलक मुक्त तसेच संयुगाच्या स्वरूपात आढळते.
- निसर्गात कार्बन हा हिरा, ग्रॅफाइट या अवस्थेत आढळतो.
- संयुग अवस्थेत (1) कार्बन डायऑक्साइड, कॅल्शिअम कार्बोनेट, मार्बल, कॅलामाइन (2) दगडी कोळसा, पेट्रोलिअम, नैसर्गिक वायू (3) पिष्टमय पदार्थ, प्रथिने, मेद (4) नैसर्गिक धागे, सुती कपडे, लोकर रेशीम यांमध्ये कार्बन आढळतो.
- पृथ्वीच्या कवचामध्ये सुमारे 27% कार्बन असून तो कार्बोनेट, कोळसा, पेट्रोलिअम स्वरूपात असतो; तर वातावरणात असणारे कार्बनचे प्रमाण कार्बन डायऑक्साइडच्या स्वरूपात सुमारे 0.03% एवढे असते.
- महासागरांच्या तळाशी असलेल्या काही प्रकारच्या वनस्पती पाण्यातील कार्बनचे रूपांतर कॅल्शिअम कार्बोनेटमध्ये करीत असतात.
कार्बनचे गुणधर्म (Properties of Carbon) :
कार्बनची अपरूपता (Allotropes of Carbon) : निसर्गात काही मूलद्रव्ये एकापेक्षा अधिक रूपात आढळतात. त्यांचे रासायनिक गुणधर्म सारखे असले तरी भौतिक गुणधर्म भिन्न असतात. मूलद्रव्यांच्या या गुणधर्माला अपरूपता म्हणतात.
- कार्बनप्रमाणेच सल्फर, फॉस्फरस ही मूलद्रव्ये सुद्धा अपरूपता दर्शवतात.
- कार्बनची अपरूपता स्फटिक रूप आणि अस्फटिक रूप अशा दोन प्रकारची असते.
स्फटिक रूपे (Crystalline forms) : हिरा, ग्रॅफाइट, फुलेरिन्स ही कार्बनची स्फटिकरूपी बहुरूपे आहेत.
(i) हिरा (Diamond) :
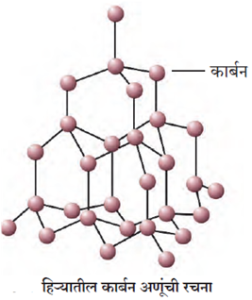
हिरा भारतामध्ये कर्नाटकात गोवळकोंडा व मध्य प्रदेशात पन्ना येथे सापडतो.
- हिऱ्यात प्रत्येक कार्बन अणू हा शेजारील चार कार्बन अणूंशी सहसंयुज बंधाने बंधित असतो. त्यामुळे तो टणक, चतुष्कोनातील त्रिमितीय रचना देतो.
- हिरा हा तेजस्वी व शुद्ध कठीण पदार्थ आहे. याची घनता 5 g/cm3 आहे व द्रवणांक 3500 °C आहे.
- हिरा 800 °C तापमानाला तापवल्यास CO2 मुक्त होतो.
- हिरा कोणत्याही द्रावणात विरघळत नाही. आम्ल/अल्कली यांचा हिऱ्यावर काहीही परिणाम होत नाही.
- हिरा विद्युत दुर्वाहक असतो.
उपयोग :
- हिऱ्याचा उपयोग काच कापणे व खडकाला छिद्र पाडण्याच्या उपकरणांमध्ये वापरतात.
- दागिन्यांमध्ये मौल्यवान खडा म्हणून हिरा वापरतात.
- डोळ्याच्या शस्त्रक्रिया करण्याच्या उपकरणांमध्ये हिऱ्यांचा वापर वापरतात.
- अवकाशात व कृत्रिम उपग्रहांमध्ये प्रारणांपासून संरक्षण करणाऱ्या खिडक्या तयार करण्यासाठी हिऱ्याचा उपयोग करतात.
(ii) ग्रॅफाइट (Graphite) :
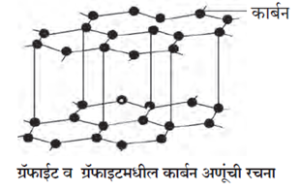
रशिया, न्यूझीलंड, अमेरिका व भारतात नैसर्गिक स्वरूपात ग्रॅफाइट आढळते.
- ग्रॅफाइटमध्ये प्रत्येक कार्बन अणू हा इतर तीन कार्बन अणूंसोबत अशा प्रकारे बंधित असतो की, त्यामुळे प्रतलीय षट्कोनी रचना तयार होते.
- निसर्गात सापडणारे ग्रॅफाइट काळे, मऊ व गुळगुळीत असते.
- ग्रॅफाइट हे विद्युत सुवाहक आहे.
- कागदावर उमटण्याची क्षमता यात असते.
- ग्रॅफाइटची घनता 9 ते 2.3 g/cm3 इतकी आहे.
- ग्रॅफाइट हे बहुतांश द्रावकांत विरघळत नाही.
उपयोग :
- वंगण तयार करण्यासाठी.
- कार्बन इलेक्ट्रोड तयार करण्यासाठी.
- ग्रॅफाइटचा वापर रंग, पॉलिश व पेन्सिलीमध्ये केला जातो.
- खूप प्रकाश देणाऱ्या आर्कलॅम्पमध्ये ग्रॅफाइट वापरतात.
(iii) फुलरिन (Fullerene) :
- फुलरिन हे कार्बनचे अपरूप निसर्गामध्ये कमी प्रमाणात सापडते.
- C60, C70, C76, C82 व C86 हे फुलरिनचे रेणू निसर्गात थोड्या प्रमाणात काजळीमध्ये आढळतात.
- फुलरिनचे रेणू बकीबॉल, बकीट्यूब्ज या स्वरूपात आढळतात.
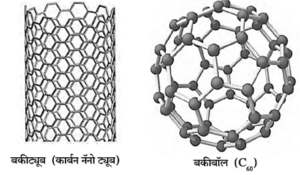
- हे रेणू साधारणतः 30 ते 900 कार्बन अणूंनी बनलेले असतात.
- हे बऱ्याचशा द्रावकांमध्ये द्रावणीय असते. उदा., कार्बन डायसल्फाइड व क्लोरो बेंझिन.
- याचा उपयोग विसंवाहक म्हणून करतात.
- फुलरिनचा उत्प्रेरक म्हणून जलशुद्धीकरणात वापर करतात.
- एका ठरावीक तापमानाला अतिवाहकता हा गुणधर्म दर्शवतो.
अस्फटिकी अपरूपे (Non- crystalline / Amorphous forms) :
यामध्ये कार्बनच्या अणूची रचना नियमित नसते.
कोक, कोल किंवा दगडी कोळसा ही कार्बनची अस्फटिकरूपी बहुरूपे आहेत.
दगडी कोळसा :
- हे एक जीवाश्म इंधन असून कार्बनच्या प्रमाणानुसार कोळशाचे पुढील चार मुख्य प्रकार आहेत : पीट 60% पेक्षा कमी, लिग्नाइट (60 ते 70%), बिट्युमिनस (70 ते 90%) व अॅन्थ्रासाइट (95%).
- कार्बनच्या प्रमाणानुसार कोळशापासूनच्या उष्णतानिर्मितीचे प्रमाण वाढत जाते.

उपयोग :
- कोळसा हे एक जीवाश्म इंधन आहे. याचा वापर कारखान्यात व घरात इंधन म्हणून करतात. कोक, कोलगॅस व कोलटार मिळवण्यासाठी कोळशाचा वापर करतात.
- विद्युतनिर्मितीसाठी औष्णिक विद्युत केंद्रात कोळसा वापरतात.
- दगडी कोळशातून कोल गॅस काढून घेतल्यावर उरणाऱ्या शुद्ध कोळशाला कोक म्हणतात. घरगुती इंधनात कोकचा वापर करतात.
- क्षपणकारक म्हणून याचा उपयोग करतात.
- वॉटर गॅस, प्रोड्युसर गॅसच्या निर्मितीत कोकचा वापर करतात.
हायड्रोकार्बन्स : मूलभूत सेंद्रिय संयुगे (Hydrocarbons : Basic Organic Compounds) :
- बहुतेक सेंद्रिय संयुगांत कार्बन व हायड्रोजन या मूलद्रव्यांचा समावेश असतो. या मूलभूत सेंद्रिय संयुगांना मूळसंयुगे म्हणतात. यांनाच हायड्रोकार्बन्स म्हणतात.
- कार्बनचे इलेक्ट्रॉन संरूपण 2, 4 आहे. म्हणून कार्बनची संयुजा 4 आहे. म्हणून तो दुसऱ्या कार्बनसोबत अथवा दुसऱ्या मूलद्रव्याच्या अणूसोबत चार सहसंयुज बंध (Covalent bond) तयार करतात.
सहसंयुज संयुगांचे गुणधर्म :
- सहसंयुज संयुगांचा द्रवणांक आणि उत्कलनांक कमी असतो.
- पाण्यात सहसंयुज संयुगे अद्रावणीय आणि सेंद्रिय द्रावकात द्रावणीय असतात.
- सहसंयुज संयुगे उष्णता आणि विद्युत यांचे कमी प्रमाणात वाहक असतात.
संतृप्त आणि असंतृप्त हायड्रोकार्बन (Saturated and Unsaturated Hydrocarbons) : संतृप्त हायड्रोकार्बन : कार्बन अणू एक वैशिष्ट्यपूर्ण गुणधर्म दाखवतो. ज्या हायड्रोकार्बनच्या सर्व कार्बन अणूंमध्ये फक्त एकेरी बंध असतो, त्यांना संतृप्त हायड्रोकार्बन असे म्हणतात.
- उदाहरणार्थ, इथेन (C2H6) म्हणजेच (CH3- CH3), प्रोपेन (CH3-CH2-CH3).
असंतृप्त हायड्रोकार्बन : काही हायड्रोकार्बनमध्ये दोन कार्बन अणूंमध्ये दुहेरी किंवा तिहेरी बहुबंध असतो. ज्या हायड्रोकार्बनमध्ये किमान एक बहुबंध असतो, त्याला असंतृप्त हायड्रोकार्बन म्हणतात.
- उदाहरणार्थ, इथीन (H2C=CH2), ईथाईन (HC≡CH), प्रोपीन (CH3-CH=CH2), प्रोपाइन (CH3-C≡CH).
कार्बनची विद्राव्यता (Solubility of Carbon ) :
- कार्बन कोणत्याही द्रावणात विरघळत नाही.
- कोळशाची पूड पाणी, रॉकेल व खाद्यतेल यांपैकी कोणत्याही द्रावणात विरघळत नाही.
कार्बनची ऑक्सिजन बरोबर अभिक्रिया (Reaction of Carbon with Oxygen)
C(s) +O2(g) → CO2(g)
कोळसा पेटल्यावर त्याची हवेतील ऑक्सिजन वायूबरोबर अभिक्रिया होते व कार्बन डायऑक्साइड (CO2) बाहेर टाकला जातो
कार्बन डाय ऑक्साइड :
- कार्बन डायऑक्साइड रेणुसूत्र-CO2, रेणुवस्तुमान-
- आढळ : कार्बन डायऑक्साइड मुक्त स्वरूपात हवेत 03% आढळतो.
- उच्छ्वासावाटे बाहेर पडणाऱ्या हवेत सुमारे 4% CO2 असतो.
- खडू, शहाबादी फरशी, लाइमस्टोन यांमध्ये तो संयुग स्वरूपात आढळतो.
- लाकूड, कोळसा या जीवाश्म इंधनांच्या ज्वलनातून CO2 तयार होतो.
- प्रयोगशाळेत, (CaCO3) चुनखडीवर हायड्रोक्लोरिक आम्ल टाकले असता, कार्बन डायऑक्साइड वायू तयार होतो.
गुणधर्म :
- या वायूला चव, रंग, वास नाही.
- तो हवेपेक्षा जड आहे.
- पाण्यात अत्यल्प विरघळतो.
- हा वायू स्वतः ज्वलनशील नाही, तसेच ज्वलनास मदतही करीत नाही.
उपयोग :
- याचा उपयोग शीतपेयांच्या निर्मितीत, शुष्क बर्फ, धुण्याचा सोडा, खाण्याचा सोडा तयार करण्यासाठी होतो.
- कॉफीमधून कॅफिन काढून टाकण्यासाठी द्रवरूप CO2 वापरतात.
- अग्निशमन वायू म्हणून कार्बन डायऑक्साइडचा वापर करतात. द्रा
- वक म्हणून CO2 चा उपयोग ड्रायक्लिनिंगमध्ये केला जातो;
- याचा उपयोग वनस्पती प्रकाश-संश्लेषणासाठी करतात.
रासायनिक गुणधर्म :
- सोडिअम हायड्रॉक्साइडच्या जलीय द्रावणातून कार्बन डायऑक्साइड पाठवल्यास सोडियम कार्बोनेट मिळते. (सोडियम कार्बोनेट - धुण्याचा सोडा)
2NaOH + CO2 → Na2CO3 + H2O
- सोडियम कार्बोनेटच्या पाण्यातील द्रावणातून CO2 पाठवला असता सोडियम बायकार्बोनेट मिळते. (सोडिअम बायकार्बोनेट - खाण्याचा सोडा)
Na2CO3 + H2O + CO2 → 2NaHCO3
2NaHCO3 + H2SO4 → Na2SO4 + 2H2O + 2CO2 ↑
- CO2 च्या वायुपात्रात चुनकळी टाकल्यावर होणाऱ्या रासायनिक अभिक्रियेचे समीकरण :
H2O +CO2 → H2CO3 (कार्बोनिक आम्ल)
Ca(OH)2 (चुनकळी) + CO2 → CaCO3 (कॅल्शिअम कार्बोनेट) + H2O
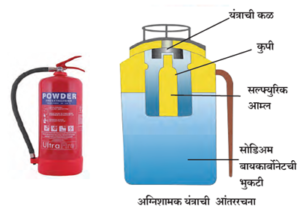
अग्निशामक यंत्र (Fire Extinguisher) :
- अग्निशामक यंत्रात सोडिअम बायकार्बोनेटची भुकटी असते. एका कुपीत विरल सल्फ्युरिक आम्ल असते.
- कळ दाबल्यावर कुपीतील आम्ल सोडिअम बायकार्बोनेटवर पडते. रासायनिक अभिक्रिया होते व त्यातून कार्बन डायऑक्साइड वायू मुक्त होऊन बाहेर पडतो.
- कार्बन डायऑक्साइड वायू जळत नाही व ज्वलनासही मदत करीत नाही. त्यामुळे जळणाऱ्या वस्तूवर कार्बन डायऑक्साइड वायू पसरल्यास हवा न मिळाल्यामुळे आग आटोक्यात येते. म्हणून आग विझवायला हा वायू उपयोगी पडतो.
2NaHCO3 + H2SO4 → Na2SO4 + 2H2O + 2CO2 ↑
- CO2 अग्निशामके ही क्षरण न होणारी व वीजप्रवाह प्रतिबंधक असतात. त्यामुळे विद्युत उपकरणे व यंत्रांना लागलेल्या आगीतही अग्निशामके वापरतात.
- आधुनिक अग्निशामक यंत्रात द्रवरूप व स्थायुरूप CO2 दाबाखाली भरलेला असतो. दाब कमी केल्यावर तो वायुरूप होऊन तो जोराने कर्ण्यासारख्या नळ्यातून बाहेर पडतो.
मिथेन - रेणुसूत्र CH4 , रेणु वस्तुमान-16
आढळ :
- नैसर्गिक वायूमध्ये सुमारे 87% मिथेन वायू आढळतो.
- जैविक पदार्थां च्य हवेच्या अनुपस्थितीत होणाऱ्या विघटनातून हा निर्माण होतो.
- बायोगॅस मध्येही मिथेन आढळतो.
- कोळशांच्या खाणींमध्ये मिथेन आढळतो.
- दलदलीच्या पृष्ठभागावर मिथेन वायू आढळून येतो, म्हणून याला मार्श गॅस असेही म्हणतात.
- प्रयोगशाळेत हायड्रोजन व कार्बन मोनॉक्साइड यांचे मिश्रण 3000C ला निकेल या उत्प्रेरकाच्या उपस्थितीत तापवल्यास मिथेन वायू तयार होतो.
- शुद्ध स्वरूपातील मिथेन नैसर्गिक वायूच्या भंजक ऊर्ध्वपातनाने मिळवता येतो.
मिथेनचे भौतिक गुणधर्म :
- मिथेनचा द्रवणांक (-182.5 0C )आहे.
- मिथेनचा उत्कलनांक (-161.5 0C) आहे.
- हा वायू रंगहीन अहे.
- द्रवरूप मिथेनची घनता पाण्याच्या घनतेपेक्षा कमी असते.
- मिथेन पाण्यामध्ये अगदी थोड्या प्रमाणात द्रावणीय असतो तर गॅसोलिन, ईथर, अल्कोहोल यांसारख्या सेंद्रिय द्रावकांमध्ये तो जास्त द्रावणीय आहे.
- कक्ष तापमानाला मिथेन हा वायू अवस्थेत असतो.
मिथेनचे रासायनिक गुणधर्म :
(i) मिथेन हा अतिशय ज्वालाग्रही असून जळताना, ऑक्सिजनबरोबर अभिक्रिया होताना निळसर ज्योत मिळते व या अभिक्रियेतून 213 kcal/mol एवढी उष्णता बाहेर टाकली जाते. मिथेन हा वायू पूर्णत: जळतो.
CH4 +2O2 → CO2 + 2H2O + उष्णता
(ii) क्लोरिनेशन (Chlorination) : अतिनील कि रणांच्या उपस् थितीत 2500C ते 4000C तापमानाला मिथेन व क्लोरिन वायूंमध्ये अभिक्रिया होऊन प्रामुख्याने मिथिल क्लोराइड (क्लोरोमिथेन) व हायड्रोजन क्लोराइड तयार होतात. या अभिक्रियेला मिथेनचे क्लोरिनेशन म्हणतात.
CH4 + Cl2 CH3Cl + HCl
मिथेनचे उपयोग :
- नैसर्गिक वायुस्वरूपातील मिथेनचा उपयोग वस्त्रोद्योग, कागदनिर्मिती, अन्नप्रक्रिया उद्योग, पेट्रोल शुद्धीकरण इत्यादी उद्योगात करतात.
- सर्वात लहान लांबीचा हायड्रोकार्बन असल्यामुळे मिथेनच्या ज्वलनातून बाहेर पडणाऱ्या CO2 चे प्रमाण खूप कमी असते म्हणून याचा वापर घरगुती इंधन म्हणून केला जातो.
- इथेनॉल, मिथाइल क्लोराइड, मिथिलीन क्लोराइड तसेच अमोनिआ व अॅसिटीलीन या कार्बनी संयुगांच्या निर्मितीसाठी मिथेनचा वापर करतात.
बायोगॅस संयंत्र :
- जनावरांचे शेण, पालापाचोळा, ओला कचरा यांचे विनॉक्सी जीवाणूंमार्फत बायोगॅस संयंत्रामध्ये विघटन होते. त्यापासून मिथेन वायू तयार होतो. यालाच बायोगॅस म्हणतात.
- बायोगॅसमध्ये सुमारे 55 ते 60% मिथेन व उर्वरित CO2 असतो.
- बायोगॅस स्वयंपाकासाठी स्वस्त इंधन पर्याय आहे.
- गॅस तयार होताना उत्तम खतही तयार होते.
- बायोगॅस संयंत्राचा उपयोग वीजनिर्मितीसाठी सुद्धा होतो.
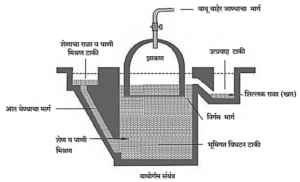
बायोगॅस निर्मिती : ही प्रक्रिया विनॉक्सी (Anaerobic) प्रकारची असते. ती दोन टप्प्यांमध्ये घडून येते :
- आम्ल निर्मिती (Production of acids) : कचऱ्यातील जैवविघटनयोग्य जटील सेंद्रिय संयुगांवर जीवाणू अभिक्रिया करतात व सेंद्रिय आम्ल (Organic Acids) तयार करतात.
- मिथेन वायू निर्मिती (Methane Gas Production) : मिथॅनोजेनिक जीवाणू सेंद्रीय आम्लांवर अभिक्रिया करून मिथेन वायू बनवतात.
CH3COOH → CH4 + CO2 ↑
Click on link to get PDF from store :
Marathi Medium-Class 9-विज्ञान आणि तंत्रज्ञान-पाठ-13-कार्बन : एक महत्त्वाचे मूलद्रव्य-Notes
Marathi Medium-Class 9-विज्ञान आणि तंत्रज्ञान-पाठ-13-कार्बन : एक महत्त्वाचे मूलद्रव्य-Solutions
Marathi Medium-Class 9-विज्ञान आणि तंत्रज्ञान-पाठ-13-कार्बन : एक महत्त्वाचे मूलद्रव्य-Text Book
महाराष्ट्र बोर्ड- कक्षा- 9 विज्ञान व तंत्रज्ञान-मराठी माध्यम सर्व 18 धड्यांची नोट्स (18 PDF) Rs. 72
Useful links :
| Main Page : - Marathi Medium-Class 9-विज्ञान आणि तंत्रज्ञान- All chapters notes, solutions, videos, test, pdf.
Previous Chapter : पाठ-12- ध्वनीचा अभ्यास - online notes Next Chapter : पाठ-14- पदार्थ आपल्या वापरातील- online notes |
