द्रव्याचे मोजमाप
Marathi Medium-Class 9-विज्ञान आणि तंत्रज्ञान-पाठ-4-Maharashtra Board
Notes
|
अभ्यासघटक :
|
ओळख :
डाल्टनचा अणुसिद्धांत :
- द्रव्य हे लहानांत लहान कणांचे बनले असून, या कणांना अणू म्हणतात.
- अणू हा कडक आणि भरीव असा गोळा आहे.
- तो द्रव्याचा सूक्ष्मतम घटक असून त्याचे विभाजन करता येत नाही.
संयुगे : मूलद्रव्यांच्या रासायनिक संयोगाने संयुगे बनतात.
रासायनिक संयोगाचे नियम (Laws of Chemical Combination) :
द्रव्य अक्षय्यतेचा नियम (Laws of Conservation of Matter) : रासायनिक अभिक्रिया होत असताना द्रव्यात वाढ किंवा घट होत नाही. रासायनिक अभिकारकांचे (Reactants) एकूण वजन व रासायनिक अभिक्रियांतून निर्माण होणाऱ्या उत्पादकांचे (Products) वजन हे सारखेच असते. यालाच द्रव्य अक्षय्यतेचा नियम असे म्हणतात.
स्थिर प्रमाणाचा नियम (Law of Constant Proportion) : संयुगाच्या विविध नमुन्यांमधील घटक मूलद्रव्यांचे वजनी प्रमाण नेहमी स्थिर असते.
उदाहरण :
निसर्गातील कोणतेही स्त्रोत असले तरी पाण्यामध्ये हायड्रोजन व ऑक्सिजन ही मूलद्रव्ये असतात; त्यांचे पाण्यातील वजनी प्रमाण 1 : 8 असते. त्याचप्रमाणे 44 ग्रॅम कार्बन डायऑक्साइडमध्ये 12 ग्रॅम कार्बन व 32 ग्रॅम ऑक्सिजन ही मूलद्रव्ये असतात व त्यांचे वजनी प्रमाण 12 : 32, म्हणजेच 3 : 8 असते.
अणू (Atom) : आकार, वस्तुमान, संयुजा (Size, Mass and Valency) :
अणू (Atom) :
- अणू हे अतिशय सूक्ष्म असतात. प्रोटॉन, न्यूट्रॉन व इलेक्ट्रॉन हे तिन्ही अणूचे मूलकण असून प्रोटॉन -धनप्रभारित, इलेक्ट्रॉन - क्रणप्रभारित, तर न्यूट्रॉन – प्रभाररहित असतो.
- अणूचा आकार हा त्याच्या त्रिज्येवरून ठरवला जातो. अणूमध्ये अणूची त्रिज्या म्हणजे अणूचे केंद्र व बाह्यतम कक्षा यांतील अंतर होय. ही त्रिज्या नॅनोमीटरमध्ये मोजली जाते.
- अणूचा आकार हा त्याच्यामध्ये असणाऱ्या इलेक्ट्रॉन कक्षांच्या संख्येवर अवलंबून असतो. कक्षांची संख्या जितकी जास्त तितका आकार मोठा. उदा., Na च्या अणूपेक्षा K चा अणू मोठा आहे.
- जर दोन अणूंची बाह्यतम कक्षा तीच असेल, तर ज्या अणूच्या बाह्यतम कक्षेत जास्त इलेक्ट्रॉन असतील त्याचा आकार ज्या अणूच्या बाह्यतम कक्षेत कमी इलेक्ट्रॉन आहेत अशाच्या तुलनेत लहान असतो. उदा., Na च्या अणूपेक्षा Mg चा अणू लहान आहे.
- अणू हे अतिशय सूक्ष्म असतात. इलेक्ट्रॉन सूक्ष्मदर्शक, फिल्ड आयन सूक्ष्मदर्शक, स्कॅनिंग टनेलिंग सूक्ष्मदर्शक अशा अत्याधुनिक साधनांमध्ये अणूची विशालित प्रतिमा दाखवण्याची क्षमता असते.
अणूचे वस्तुमान (Mass of Atom) :
- अणूचे वस्तूमान त्याच्या केंद्रकात एकवटलेले असून ते त्यातील प्रोटॉन (p) व न्यूट्रॉन (n) मुळे असते.
- अणुकेंद्रकामध्ये असणाऱ्या प्रोटॉन व न्यूट्रॉनच्या एकत्रित संख्येला (p+n) अणु वस्तुमानांक (Atomic Mass Number), A म्हणतात.
- प्रोटॉन व न्यूट्रॉन यांना एकत्रितपणे अणु केंद्रातील मूलकण (Nucleons) असे संबोधतात.
- अणुवस्तुमानासाठी एकीकृत वस्तुमान (Unified mass) हे परिमाण वापरले जाते. या परिमाणाला डाल्टन म्हणतात. यासाठी u ही संज्ञा वापरतात.
1 u = 1.66053904 x 10~27 kg.
मूलद्रव्ये व त्यांची अणुवस्तुमान :
| मूलद्रव्ये | अणुवस्तुमान |
| हायड्रोजन | 1 |
| हेलिअम | 4 |
| लिथिअम | 7 |
| बेरिलिअम | 9 |
| बोरॉन | 11 |
| कार्बन | 12 |
मूलद्रव्यांच्या रासायनिक संज्ञा (Chemical symbols of Elements)
- मूलद्रव्यांच्या आद्याक्षररूपी संक्षेपास मूलद्रव्याची संज्ञा म्हणतात.
- मूलद्रव्याची संज्ञा ही त्याच्या नावातील पहिले अक्षर किंवा पहिले आणि दुसरे / इतर विशिष्ट अक्षर अशी असते. दोन अक्षरांपैकी पहिले अक्षर इंग्रजी मोठ्या लिपीत व दुसरे अक्षर लहान लिपीत लिहितात
उदाहरणे :
- मूलद्रव्याची संज्ञा ही त्याच्या नावातील पहिले अक्षर असणारी उदाहरणे : हायड्रोजन (Hydrogen)-H, कार्बन (Carbon)-C, नायट्रोजन (Nitrogen)-N.
- मूलद्रव्याची संज्ञा ही त्याच्या नावातील पहिले आणि दुसरे अक्षर असणारी उदाहरणे : कॅल्शिअम (Calcium) - Ca, अँल्युमिनिअम (Aluminium) - Al, हेलिअम (Helium) - He.
- मूलद्रव्याची संज्ञा ही त्याच्या नावातील पहिले आणि तिसरे अक्षर असणारी उदाहरणे : कॅडमिअम (Cadmium) –Cd मॅग्नेशिअम (Magnesium)-Mg, क्लोरीन (Chlorine)-Cl.
रेणु वस्तुमान आणि मोलची संकल्पना :
मूलद्रव्यांचे आणि संयुगांचे रेणू (Molecules of Elements and Compounds) :
रेणू : मूलद्रव्यांच्या दोन किंवा अधिक अणूंच्या संयोगातून रेणू तयार होतात. काही मूलद्रव्ये एक-अणू-रेणू. अवस्थेत असतात, तर काही बहू-अणू-रेणू अवस्थेत असतात.
रेणुवस्तुमान (Molecular Mass) : एका रेणूमधील सर्व अणूंच्या अणुवस्तुमानाची बेरीज म्हणजेच पदार्थाचे रेणुवस्तुमान होय. रेणुवस्तुमानसुद्धा डाल्टन (u) याच एककात व्यक्त करतात.
काही मूलद्रव्यांची अणुवस्तुमाने : H(1), O(16), N(14), C(12),K (39), S (32) Ca(40), Na(23), Cl(35.5), Mg(24), Al(27).
उदाहरण : H2O चे रेणुवस्तुमान कसे काढता येईल?
रेणुवस्तुमान = घटक अणुवस्तुमानांची बेरीज
हायड्रोजन (H) चे अणुवस्तुमान = 1, ऑक्सिजन (O) चे अणुवस्तुमान = 16
∴ (H2O च रेणुवस्तुमान) = (H चे अणुवस्तुमान) x 2 + (O चे अणुवस्तुमान) x 1
= 1 x 2 + 16 x 1
= 2 + 16 = 18
| माहिती साठी :
· कोणत्याही पदार्थाच्या एका रेणूचे वजन वजनकाटा वापरून करणे शक्य नाही. · वेगवेगळ्या पदार्थांच्या समान वजन असलेल्या राशीमध्ये त्या पदार्थांच्या रेणूंची संख्या वेगवेगळी असते. · एखाद्या पदार्थांच्या दिलेल्या राशीतील रेणूंची संख्या त्या पदार्थांच्या रेणुवस्तुमानावर ठरते. · वेगवेगळ्या पदार्थांच्या 1 मोल राशींची ग्रॅममधील वस्तुमाने वेगवेगळी असतात. |
मोल (Mole) : ग्रॅममध्ये व्यक्त केलेले त्या पदार्थाचे अणुवस्तुमान किंवा रेणुवस्तुमान डाल्टनमधील मूल्याएवढेच असते; म्हणजेच पदार्थांचा एक मोल होय. .
![]()
मोल (mol) हे SI एकक आहे.
उदाहरणे :
- ऑक्सिजनचे रेणुवस्तुमान 32 (u) आहे. 32 ग्रॅम ऑक्सिजन म्हणजे 1 मोल होय.
- कार्बनचे अणुवस्तुमान 12 (u) आहे. 12 ग्रॅम कार्बन म्हणजे 1 मोल होय.
ॲव्हागॅड्रो अंक (Avogadro’s number) :
एक मोल अणू /रेणू राशीमध्ये नेहमी 6.022 x 1023 इतके अणू /रेणू असतात. या संख्येलाच अव्हागॅड्रो अंक (अव्हागॅड्रो स्थिरांक) म्हणतात व तो NA या अक्षराने दर्शवतात.
- पाण्याच्या 18 ग्रॅम, म्हणजेच 1 मोलमध्ये पाण्याचे 022 x 1023 इतके रेणू असतात.
उदाहरण :
प्रश्न. 66 ग्रॅम CO2 मध्ये किती रेणू असतात ते काढा.
रीतः
CO2 चे रेणुवस्तु मान 44 अहे.
![]()
∴ n= 1.5 मोल (mol)
∴ 1 मोल CO2 मध्ये 6.022 x 1023 रेणू असतात.
∴ 1.5 मोल CO2 मध्ये 1.5 x 6.022 x 1023 रेणू = 9.033 x 1023 रेणू असतात.
संयुजा (Valency) : मूलद्रव्याच्या संयोग पावण्याच्या क्षमतेला संयुजा म्हणतात.
- आयनिक बंध निर्माण होताना त्या मूलद्रव्यांच्या अणूंची इलेक्ट्रॉन देण्याची किंवा घेण्याची संख्या म्हणजे संयुजा होय.
- सोडिअम क्लोराइड (NaCl) मध्ये सोडिअमची संयुजा 1 आहे व क्लोरीनची संयुजा 1 आहे आणि सोडिअम व क्लोरीनमध्ये आयनिक बंध असतो.
- धन प्रभारित आयनांना कॅटायन म्हणतात, तर ऋण प्रभारित आयनांना अनायन म्हणतात. मूलद्रव्यांच्या बाह्यतम कक्षेत असणाऱ्या इलेक्ट्रॉन्सना संयुजा इलेक्ट्रॉन म्हणतात. उदा. MgCl2 मध्ये Mg++, Cl— याप्रमाणे धन व ऋण आयन असतात.
- दिल्या किंवा घेतल्या जाणाऱ्या e— ची संख्या नेहमी पूर्णांक संख्या असते. म्हणून संयुजा नेहमी पूर्णांकातच असते.
संयुजा इलेक्ट्रॉन : मूलद्रव्यांच्या बाह्यतम कक्षेत असणाऱ्या इलेक्ट्रॉन्सना संयुजा इलेक्ट्रॉन म्हणतात.
उदाहरण : ऑक्सिजनची संयुजा 2 आहे.
- अणूच्या बाह्यतम कक्षेत अष्टक स्थिती प्राप्त होण्यासाठी दिल्या किंवा घेतल्या जाणाऱ्या इलेक्ट्रॉनच्या संख्येला त्या मूलद्रव्याची संयुजा म्हणतात.
- ऑक्सिजनचे इलेक्ट्रॉन संरूपण 2, 6 आहे. त्याच्या संयुजा कक्षेत 6 इलेक्ट्रॉन आहेत. त्याने 2 इलेक्ट्रॉन घेतले असता बाह्यतम कक्षेत इलेक्ट्रॉन अष्टक तयार होते व ऋणप्रभारिति ऑक्सिजन तयार होतो; म्हणून ऑक्सिजनची संयुजा 2 आहे.
परिवर्ती संयुजा : वेगवेगळ्या परिस्थितीत मूलद्रव्यांचे अणू वेगवेगळ्या संख्येने इलेक्ट्रॉन (e—) देतात किंवा घेतात. अशा वेळी ते एकापेक्षा जास्त संयुजा दाखवतात. अशा संयुजांना परिवर्ती संयुजा म्हणतात.
उदाहरण : लोह (आयर्न) 2 व 3 परिवर्ती संयुजा दर्शवतो. त्यामुळे क्लोरीन-बरोबर त्याची अभिक्रिया झाल्यास FeCl2 व FeCl3 अशी दोन संयुगे तयार होतात.
मूलके : धनप्रभारित (कॅटायन) किंवा ऋणप्रभारित अणू (अँनायन) हे घटक स्वतंत्रपणे रासायनिक अभिक्रियांमध्ये भाग घेतात, त्यांना मूलके म्हणतात.
उदा.
Na+ सोडिअम आयन व Cl— क्लोराइड आयन.
K+, Mg2+, Al3+ ही धन मूलके यांनाच कॅटायन किंवा आम्लारिधर्मी मूलके म्हणतात.
Cl—, SO42—, CO32— ही ऋण मूलके यांनाच अँनायन किंवा आम्लधर्मी मूलके म्हणतात.
(i) साधे मूलक : साधे मूलक हे एकाच मूलद्रव्याच्या अणूपासून / अणुंपासून बनलेले असते व ते धनप्रभारित किंवा ऋण प्रभारित असते.
धनप्रभारित साधी मूलके : K+, Mg2+, Al3+
ऋण प्रभारित साधी मूलके : Cl—, SO42—, CO32—
(ii) संयुक्त मूलक : संयुक्त मूलकांमध्ये अणूंचा गट दोन किंवा अधिक मूलद्रव्यांच्या अणूंपासून तयार झालेला असतो. संयुक्त मूलके धनप्रभारित व ऋणप्रभारित असतात.
उदाहरणे : NH4+, CO32—, SO42—, PO43—
संयुगाची रासायनिक सूत्रे :
- विविध मूलद्रव्याचे, संयुगाचे रेणूसुत्रे लिहिण्यासाठी मूलद्रव्य किंवा मूलकाची संज्ञा व संयुजा माहीत असणे आवश्यक असते.
- रेणुसूत्र लिहिताना आयनांवरील प्रभार दाखवत नाहीत मात्र त्या त्या आयनांची संख्या संज्ञेच्या उजव्या बाजूला पायाशी लिहितात.
- संयुक्त मूलकाची संख्या 2 किंवा जास्त असल्यास मूलकाची संज्ञा कंसात लिहून संख्या कंसाबाहेर उजवीकडे पायाशी लिहीतात.
- संयुजांच्या तिरकस गुणाकार पद्धतीने ही संख्या मिळवणे सोपे जाते.
उदा.,
(i) सोडिअम सल्फेट या संयुगाचे रासायनिक सूत्र लिहिण्याच्या पायऱ्या.
पायरी 1 : मूलकांच्या संज्ञा लिहिणे (आम्लारिधर्मी मूलक डाव्या बाजूला.)
Na SO4
पायरी 2 : त्या त्या मूलकाच्या खाली त्याची संयुजा लिहिणे.
Na SO4
1 2
पायरी 3 : मूलकाची संख्या मिळवण्या साठी बाणाने दर्शवल्या प्रमाणे तिरकस गुणाकार करणे.
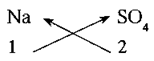
पायरी 4 : संयुगाचे रासायनिक सूत्र लिहिणे.
Na2SO4
Click on link to get PDF from store :
Marathi Medium-Class 9-विज्ञान आणि तंत्रज्ञान-पाठ-4- द्रव्याचे मोजमाप-Notes
Marathi Medium-Class 9-विज्ञान आणि तंत्रज्ञान-पाठ-4- द्रव्याचे मोजमाप-Solutions
Marathi Medium-Class 9-विज्ञान आणि तंत्रज्ञान-पाठ-4- द्रव्याचे मोजमाप-Text Book
Useful links :
| Main Page : - Marathi Medium-Class 9-विज्ञान आणि तंत्रज्ञान- All chapters notes, solutions, videos, test, pdf.
Previous Chapter : पाठ-3- धाराविद्युत - online notes Next Chapter : पाठ-5- आम्ल, आम्लारी व क्षार- online notes |