आम्ल, आम्लारी व क्षार
Marathi Medium-Class 9-विज्ञान आणि तंत्रज्ञान-पाठ-5-Maharashtra Board
Notes
|
अभ्यासघटक :
|
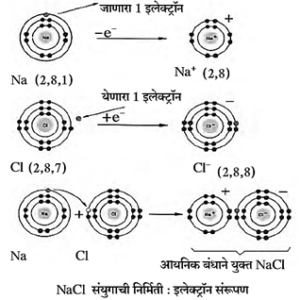
आयनिक संयुगेः एक पुनरावलोकन
आयनिक संयुगाचे तीन प्रकार : आम्ल, आम्लारी व क्षार.
आयनिक बंध : आयनिक संयुगात दोन घटक असतात व ते म्हणजे कॅटायन (धन आयन / आम्लारिधर्मी मूलक) व ॲनायन (ऋण आयन / आम्लधर्मी मूलक). या आयनांमध्ये कॅटायनवरील एक धनप्रभार व अँनायनवरील एक ऋणप्रभार यांच्यातील आकर्षण बल म्हणजेच एक आयनिक बंध होय.
उदा., सोडिअम क्लोराइड (NaCl). Na+ व Cl— ह्या विरुद्ध प्रभारित आयनांमध्ये अयनिक बंध तयार झाल्यामुळे NaCl हे अतिशय स्थैर्य असलेले अयनिक संयुग तयार होते.
मिश्रणे : पाणी व मीठ, पाणी व साखर या दोन्हींमध्ये, पाण्यामध्ये मीठ व साखर विरघळते; म्हणून ही समांगी मिश्रणे आहेत. पाणी व तेल, पाणी व लाकडाचा भुसा ही दोन्हीही विषमांगी मिश्रणे आहेत.
- जेव्हा आयनिक संयुग पाण्यात विरघळते तेव्हा त्याचे जलीय द्रावण तयार होते
आयनिक संयुगांचे विचरण :
जेव्हा एखादे स्थायुरूपातील आयनिक संयुग पाण्यात विरघळायला सुरुवात होते तेव्हा पाण्याचे रेणू संयुगाच्या आयनांच्या मध्ये घुसतात व त्यांना एकमेकांपासून वेगळे करतात म्हणजेच जलीय द्रावण होताना आयनिक संयुगांचे विचरण होते.
![]()
अऱ्हेनिअसचा आम्ल व आम्लारी सिद्धांत (Arrhenius Theory of Acids and Bases)
आम्लः आम्ल म्हणजे असा पदार्थ की जो पाण्यात विरघळला असता त्याच्या द्रावणात H+ (हायड्रोजन आयन) हे एकमेव कॅटायन तयार होतात. उदा. HCl, H2SO4, H2CO3.

आम्लारीः आम्लारी म्हणजे असा पदार्थ की जो पाण्यात विरघळला असता त्याच्या द्रावणात OH— (हायड्रॉक्साइड आयन) हे एकमेव अॅनायन तयार होतात. उदा., NaOH, Ca(OH)2.

आम्ल व आम्लारींचे वर्गीकरण (Classification of Acids and Bases)
(i) तीव्र व सौम्य आम्ल, आम्लारी आणि अल्क (Strong and Weak Acids, Bases and Alkali ) :
तीव्र आम्ल (Strong Acid) : आम्ल पाण्यात विरघळले असता त्याचे विचरण जवळजवळ पूर्ण होते व त्याच्या जलीय द्रावणात H+ व संबंधित आम्लाचे आम्लधर्मी मूलक हे आयनच असतात. त्यांना तीव्र आम्ल म्हणतात.
- उदाहरणार्थ HCl, HBr, HNO3 , H2SO4.
सौम्य आम्ल (Weak Acid) : आम्ल पाण्यात विरघळले असता त्याचे विचरण पूर्ण होत नाही व त्याच्या जलीय द्रावणात थोड्या प्रमाणात H+ व संबंधित आम्लाचे आम्लधर्मी मूलक या आयनांच्या बरोबरच विचरण न झालेले आम्लाचे रेणू मोठ्या प्रमाणात असतात, त्यांना सौम्य आम्ल म्हणतात.
- उदाहरणार्थ, H2CO3, CH3
तीव्र आम्लारी (Strong Base) : आम्लारी पाण्यात विरघळले असता त्याचे विचरण जवळजवळ पूर्ण होते व त्याच्या जलीय द्रावणात OH— व संबंधित आम्लारीचे आम्लारिधर्मी मूलक हे आयनच असतात, त्यांना तीव्र आम्लारी म्हणतात.
- उदाहरणार्थ, NaOH, KOH, Ca(OH)2, Na2
सौम्य आम्लारी (Weak Base) : आम्लारी पाण्यात विरघळले असता त्याचे विचरण पूर्ण होत नाही व त्या जलीय द्रावणात कमी प्रमाणातील OH—व संबंधित आम्लारिधर्मी मूलकाबरोबरच विचरण न झालेले आम्लारीचे रेणू मोठ्या प्रमाणात असतात, त्यांना सौम्य आम्लारी म्हणतात.
- उदाहरणार्थ, NH4
अल्क (Alkali) : जे आम्लारी पाण्यात मोठ्या प्रमाणात विद्राव्य असतात, त्यांना अल्क म्हणतात.
- उदाहरणार्थ, NaOH, KOH, NH3 यांपैकी NaOH व KOH हे तीव्र अल्क आहेत, तर NH3 हा सौम्य अल्क आहे.
(ii) आम्लारिधर्मता व आम्लधर्मता (Basicity and Acidity) :
- आम्लाची आम्लारिधर्मताः आम्लाच्या एका रेणूपासून विचरणाने जितके H+ आयन मिळू शकतात ती संख्या म्हणजे त्या आम्लाची आम्लारिधर्मता होय.
- आम्लारींची आम्लधर्मताः आम्लारीच्या एका रेणूपासून विचरणाने जितके OH— आयन मिळू शकतात ती संख्या म्हणजे आम्लारीची आम्लधर्मता होय.
आम्ल व आम्लारीची संहती (Concentration of Acid and Base) :
- द्राव्याच्या राशीचे द्रावणाच्या राशीशी असलेल्या प्रमाणाला द्राव्याची द्रावणातील संहती म्हणतात.
- जेव्हा द्रावणात द्राव्याची संहती जास्त असते, तेव्हा त्या द्रावणाला संहत द्रावण म्हणतात; तर द्रावणात द्राव्याची संहती कमी असते, तेव्हा त्या द्रावणाला विरल द्रावण म्हणतात.
द्रावणाची संहती व्यक्त करण्याकरिता अनेक एककांचा उपयोग केला जातो.
ग्रॅम प्रति लीटर : द्रावणाच्या एक लीटर आकारमानात विरघळलेल्या स्थितीत असलेल्या द्राव्याचे ग्रॅममधील वस्तुमान म्हणजेच ग्रॅम प्रति लीटर होय.
द्रावणाची रेणुता (Molarity, M) : द्रावणाच्या एक लीटर आकारमानात विरघळलेली द्राव्याची मोलमध्ये व्यक्त केलेली राशी, यालाच द्रावणाची रेणुता (Molarity, M) म्हणतात.
- उदाहरणार्थ [NaCl] = 1 मोल/लीटर याचा अर्थ मिठाच्या (NaCl) द्रावणाची रेणूता 1M (1 मोलार) आहे असा होतो.
विविध जलीय द्रावणांच्या संहती तक्ता:

द्रावणाचा सामू (pH of Solution)
pH मूल्य द्रावणाचा आम्लधर्म किंवा आम्लारिधर्म दर्शवते. याच्या साहाय्याने हायड्रोजन आयनांची संहती मोजता येते.
सामू मापनश्रेणी : सामू मापनश्रेणीवर 0 (शून्य) (जास्त आम्लयुक्त) पासून 14 (जास्त आम्लारियुक्त) असे वाचन करता येते.
- सामू मापनश्रेणीच्या साहाय्याने द्रावणातील हायड्रोजन आयनांची संहती मोजता येते. जलीय द्रावणात जेवढे जास्त H— आयन तेवढे त्या द्रावणाचे सामू मूल्य कमी होते.
- शुद्ध पाण्याचा सामू 7 असतो, तर [H+] आयनांची संहती = 1 x 107 मोल/लीटर असते. सामू 7 हा द्रावण उदासीन दर्शवतो.
- 25 °C या तापमानाला 1 M HCl या द्रावणात H+ आयनांची संहती 1 x 10° मोल/लीटर असते; तर 1M NaOH या द्रावणात H+ आयनांची संहती 1 x 10—14 मोल/लीटर असते.
- आम्ल व आम्लारीचा सामू : सामू मूल्य द्रावणाचा आम्लधर्म किंवा आम्लारिधर्म दर्शवते. जेव्हा सामू मूल्य 0 ते 7 च्यादरम्यान असते, तेव्हा द्रावण आम्लधर्मी असते; तर 7 ते 14 यांदरम्यान द्रावण आम्लारिधर्मी/अल्कलाइन असते. सामू मूल्य 7 असताना द्रावण उदासीन असते.
सामान्य जलीय द्रावणांचा सामू :

वैश्विक दर्शक (Universal Indicators) :
- अनेक संश्लिष्ट दर्शकांच्या विशिष्ट प्रमाणात एकत्रित मिश्रणाला वैश्विक दर्शक म्हणतात.
- वैश्विक दर्शकाचे द्रावण किंवा त्यापासून बनवलेल्या कागदी सामू दर्शकपट्टिकेचा उपयोग करून दिलेल्या द्रावणाचा सामू ठरवता येतो.
- सामूमापक (pH meter) हे विद्युतसाधन सामू मोजण्याची सर्वांत अचूक पद्धत आहे.
आम्ल व आम्लारींच्या अभिक्रिया :
उदासिनीकरण (Neutralization) : आम्लाची आम्लारीशी अभिक्रिया केली असता, क्षार व पाणी तयार होते; या क्रियेला उदासिनीकरण म्हणतात.
HCl + NaOH → NaCl + H2
आम्ल आम्लारी क्षार पाणी
धातूंबरोबर आम्लांची अभिक्रिया :
धातूची विरल आम्लाबरोबर अभिक्रिया केली असता, आम्लातील हायड्रोजनला धातू विस्थापित करतो व ज्वलनशील हायड्रोजन वायू मुक्त होतो. धातूचे रूपांतर आम्लारिधर्मी मूलकामध्ये होऊन आम्लातील आम्लधर्मी मूलकाशी त्याचा संयोग होतो व क्षार तयार होतो.
धातू + विरल आम्ल → क्षार + हायड्रोजन

धातूंच्या ऑक्साइडबरोबर आम्लांची अभिक्रिया :
धातूंच्या ऑक्साइडबरोबर आम्लांची अभिक्रिया केल्यास धातूंचे क्षार व पाणी तयार होतात. धातूंची ऑक्साइडे आम्लारिधर्मी असतात.
धातूचे ऑक्साइड + विरल आम्ल → क्षार + पाणी

अधातूंच्या ऑक्साइडबरोबर आम्लारींची अभिक्रिया :
अधातूंच्या ऑक्साइडबरोबर आम्लारी अभिक्रिया केल्यास धातूचे क्षार व पाणी तयार होतात. अधातूंची ऑक्साइडे आम्लधर्मी असतात.
अधातूचे ऑक्साइड + आम्लारी → क्षार + पाणी

धातूंच्या कार्बोनेट व बायकार्बोनेट क्षारांबरोबर आम्लां ची अभिक्रिया :
आम्लाची धातूच्या कार्बोनेट किंवा बायकार्बोनेट बरोबर अभिक्रिया झाल्यास त्या धातूचे क्षार, CO2 आणि H2O तयार होतात.

क्षार (Salts)
क्षारांचे प्रकार : आम्लधर्मी , आम्लारिधर्मी व उदासीन क्षार
(i) तीव्र आम्ल व सौम्य आम्लारी यांच्या उदासिनीकरणाने आम्लधर्मी क्षार तयार होतो. या क्षाराच्या जलीय द्रावणाचा सामू 7 पेक्षा कमी असतो.
HNO3(aq) + NH4OH(aq) → NH4NO3(aq) + H2O
(ii) तीव्र आम्लारी व सौम्य आम्ल यांच्या उदासिनीकरणाने आम्लारिधर्मीं क्षार तयार होतो. या क्षाराच्या जलीय द्रावणाचा सामू 7 पेक्षा जास्त असतो.
2NaOH(aq) + H2CO3(aq) → Na2CO3(aq) + H2O
(iii) तीव्र आम्ल. व तीव्र आम्लारी यांच्या उदासिनीकरणाने उदासीन क्षार तयार होतो. उदासीन क्षाराच्या जलीय द्रावणाचा सामू 7 असतो.
HCl (aq) + NaOH (aq) → NaCl (aq) + H2O
उदासीन
स्फटिकजल (Water of Crystallization)
आयनिक संयुगे स्फटिकस्वरूप असतात. त्यांची स्फटिकी संरचना आयनांच्या विशिष्ट मांडणीतून तयार होते. काही संयुगांच्या स्फटिकांमध्ये पाण्याच्या रेणूंची संख्या निश्चित असते व या रेणूंचासुद्धा समावेश या मांडणीमध्ये झालेला असतो. गरम केल्याने किंवा काही काळ नुसते ठेवण्यानेही स्फटिकजल बाहेर पडते व त्या भागाचे स्फटिकरूप नष्ट होते. यालाच स्फटिकजल म्हणतात. उदा., मोरचूदचे (कॉपर सल्फेट) रेणुसूत्र CuSO4.5H2O
स्फटिकजल हे रासायनिक संयुगाच्या रासायनिक सूत्राच्या विशिष्ट प्रमाणात असते. रासायनिक सूत्रात ते पुढीलप्रमाणे दर्शवतात :
- स्फटिकरूप मोरचूद - CuSO4.5H2O
- स्फटिकरूप फेरस सल्फेट (ग्रीन व्हिट्रिऑल)- FeSO4.7H2O
- स्फटिकरूप सोडा- Na2CO3.10H2O
- तुरटी - K2SO4.Al2(SO4)3.24H2O
आयनिक संयुगे व विद्युत वाहकता :
NaCl, CuSO4, हे क्षार आहेत. H2SO4, हे तीव्र आम्ल व NaOH हे तीव्र आम्लारी आहे. यांचे जलीय द्रावणात जवळजवळ पूर्णपणे विचरण होते. यामुळे या जलीय द्रावणात मोठ्या प्रमाणावर धन आयन व ऋण आयन तयार होतात. म्हणून या संयुगांची जलीय द्रावणे विद्युत वाहक आहेत.
आयनांचे विचरण आणि विद्युत वाहकता (Dissociation of Ions and Electrical Conductivity)
द्रव अवस्थेचे वैशिष्ट्य म्हणजे कणांना असलेली गतिमानता (Mobility). हया गतिमानतेमुळे द्रावणातील धन आयन हे ऋणाग्राकडे आकर्षले जातात व ऋणाग्राच्या दिशेने प्रवास करतात. याउलट द्रावणातील ऋण आयन धनाग्राच्या दि शने प्रवास करतात. द्रावणातील आयनांचा संबंधि त
विदयुतअग्राच्या दिशेने प्रवास म्हणजेच द्रावणातून विद्युतवहन होय. द्रव/द्रावणामध्ये आयनांचे मोठ्या प्रमाणात विचरण झाल्याने त्यांना विद्युतवाहकता प्राप्त होते.
विदयुत अपघटन (Electrolysis)
विद्युत अपघटनी पदार्थ (Electrolyte) : विद्युत अपघटन होण्यासाठी द्रवात /द्रावणात आयनांचे मोठ्या प्रमाणात विचरण होणे आवश्यक असते. म्हणून ज्या पदार्थांचे द्रावणात/द्रवरूप अवस्थेत मोठ्या प्रमाणावर विचरण होते, त्यांना विद्युत अपघटनी पदार्थ (Electrolyte) म्हणतात.
क्षार, तीव्र आम्ल, तीव्र आम्लारी हे विद्युत अपघटनी पदार्थ आहेत. हे पदार्थ द्रवरूपात व द्रावण अवस्थेत विजेचे सुवाहक आहेत.

विद्युत अपघटनी पदार्थाचे उपयोग : (i) अपघटन करणे (ii) विद्युत विलेपन करणे.
विद्युत अपघटनी घट : विद्युत अपघटन करण्यासाठी पात्रामध्ये विद्युत अपघटनी पदार्थ (द्रवरूप/द्रावण) घेऊन त्यात विद्युत अग्रे बुडवल्यावर जी रचना तयार होते, तिला विद्युत अपघटनी घट म्हणतात.
पाण्याचे विद्युत अपघटन (Electrolysis of water)
आम्लयुक्त किंवा आम्लारीयुक्त पाण्यातून विद्युतधारा जाऊ दिली असता त्याचे पृथक्करण होऊन ऋणाग्रापाशी हायड्रोजन वायू तयार होतो व धनाग्रापाशी ऑक्सिजन वायू तयार होतो. यालाच
पाण्याचे विद्युत अपघटन म्हणतात.
- ऋणाग्र अभिक्रिया : 2H2O + 2e— → H2(g) + 2OH—(aq)
- धनाग्र अभिक्रिया : 2H2O → O2(g) + 4H—(aq) + 4e—
Click on link to get PDF from store :
Marathi Medium-Class 9-विज्ञान आणि तंत्रज्ञान-पाठ-5- आम्ल, आम्लारी व क्षार-Notes
Marathi Medium-Class 9-विज्ञान आणि तंत्रज्ञान-पाठ-5- आम्ल, आम्लारी व क्षार-Solutions
Marathi Medium-Class 9-विज्ञान आणि तंत्रज्ञान-पाठ-5- आम्ल, आम्लारी व क्षार-Text Book
महाराष्ट्र बोर्ड- कक्षा- 9 विज्ञान व तंत्रज्ञान-मराठी माध्यम सर्व 18 धड्यांची नोट्स (18 PDF) Rs. 72
Useful links :
| Main Page : - Marathi Medium-Class 9-विज्ञान आणि तंत्रज्ञान- All chapters notes, solutions, videos, test, pdf.
Previous Chapter : पाठ-4- द्रव्याचे मोजमाप - online notes Next Chapter : पाठ-6- वनस्पतींचे वर्गीकरण- online notes |
